Spektralserie
- 1455
- 249
- Rieke Scheer
Der Spektralserie Sie bestehen aus einer Reihe farbiger Linien auf dunklem Hintergrund oder hellen Streifen, die durch dunkle Bereiche getrennt sind, die Licht aus allen Arten von Substanzen abgeben.
Diese Linien werden mit Hilfe eines Spektrometers, eines Geräts, das aus einem Prisma oder einem fein geteilten Rack besteht, sichtbar gemacht, die die verschiedenen Komponenten des Lichts trennen können.
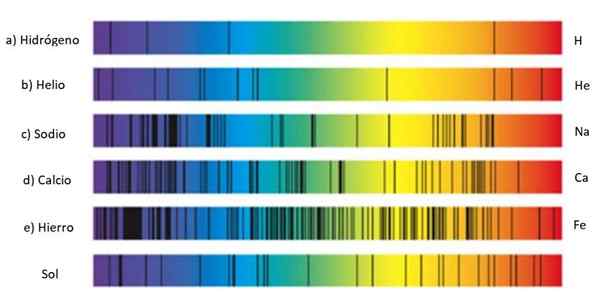
 Absorptionsspektren verschiedener Substanzen und Sonne. Quelle: Wikmedia Commons.
Absorptionsspektren verschiedener Substanzen und Sonne. Quelle: Wikmedia Commons. Diese Zeilensätze werden genannt Spektrum Und jede Substanz hat ein Karakateristenspektrum, eine Art Fingerabdruck, der dazu dient, seine Anwesenheit in dem Licht zu identifizieren, das von einem Objekt stammt. Dies liegt daran, dass jedes Atom eine eigene Elektronenkonfiguration hat und Energieniveaus zulässt.
Deshalb ist das Finden der Spektrallinien eine Technik, die von Astronomen weit verbreitet ist, um die Zusammensetzung der Sterne durch das Licht herauszufinden, das sie emittieren. Tatsächlich stammt alles, was Astronomen über die Sterne wissen, aus ihren Spektren, sei es Emission oder Absorption.
Der Ursprung der Spektren
Das Vorhandensein von Spektren ist auf die Atomkonfiguration zurückzuführen. In der Tat verbleiben Elektronen um den Kern in Regionen, die genannt werden Orbitale, befindet sich in bestimmten diskreten Entfernungen von ihm.
Zum Beispiel in Wasserstoff, dem einfachsten Element, sind die Orbitalradios durch 0 gegeben.053 ∙ n2 Nanometer, wobei n = 1, 2, 3, 4, .. . Zwischen ihnen sind nicht zulässig, daher wird gesagt, dass die Orbitale sind quantisiert. Auch der Energiezustand jedes Orbitals wird quantisiert.
Solche Einschränkungen verhalten Elektronen gleichzeitig mit Partikeln und auch als Wellen, genau wie Licht. Elektronen können jedoch von einem Orbital zum anderen wechseln und den Energiezustand des Atoms verändern.
Elektromagnetische Energieabsorption und Emission
Wenn beispielsweise ein Elektron von einem internen Orbital mit weniger Energie zu einem anderen externen und energischen Umlaufbahn führt, ist es notwendig, die erforderliche elektromagnetische Energie zu erwerben, die im Atom gespeichert ist. Dieser Prozess wird genannt Absorption.
Wenn das Elektron von einem weiteren externen Orbital zu einem internen geht, wird im Übergang ein Photon in Lichtform emittiert, was die Energiedifferenz zwischen den Orbitalen entspricht. Die Wellenlänge entspricht diesem Unterschied und wird gegeben durch:
Kann Ihnen dienen: Orion Nebula: Herkunft, Ort, Eigenschaften und Daten
- E ist Energie
- λ ist die Wellenlänge
- H ist Plancks Konstante
- C ist die Lichtgeschwindigkeit
Arten von Spektren
Es gibt sowohl Absorptions- als auch Emissionsspektren, die von bestimmten Parametern des Objekts oder der Substanz abhängt, wie z. B. Dichte und Temperatur. Das Spektrum eines schwachen Gases unterscheidet sich von dem eines Feststoffs bei hoher Temperatur.
Kontinuierliches Spektrum
Einige Quellen geben Spektren ab, deren farbige Linien sich sanft ändern und alle Farben enthalten. Dies wird als kontinuierliches Spektrum bezeichnet, zum Beispiel das, das das Filament einer Glühlampe erzeugt.
Emissionsspektrum
Es ist derjenige, der bestimmte heiße Substanzen emittiert und aus einigen Zeilen einer bestimmten Wellenlänge besteht.
Diese Art von Spektrum wird durch schwache und heiße Gase erzeugt, wie z. B. solche, die die Fluoreszenzrohre füllen. Boreal Aurora ist ein weiteres Beispiel für Emissionen, das in den Gasen der oberen Atmosphäre der Erde auftritt. Sie produzieren auch Emissionsspektren einige interstellare Gaswolken.
Absorptionsspektrum
Dieses Spektrum wird empfangen, wenn das Licht eines dichten und sehr heißen Objekts durch ein kälteres Gas geleitet wird. Darin werden fast alle Farben beobachtet, aber einige erscheinen vermindert und einige dunkle Streifen entstehen in diesen Wellenlängen, die von Atomen oder Gasmolekülen absorbiert werden.
Kirchoff -Spektroskopiegesetze
Kirchoffs Spektroskopiegesetze geben unter den unterschiedlichen Bedingungen an, die die oben beschriebenen Spektren gebildet werden:
- Kontinuierliche Spektren: Sie werden von jedem Objekt bei hohem Druck und Temperatur emittiert.
- Die Emissionsspektren: Sie werden durch einen niedrigen Druck bei niedrigem Druck erzeugt, der gut definierte Wellenlängen emittiert, die den elektronischen Übergängen entsprechen, die jedem Element entsprechen, aus dem das Gas besteht.
- Absorptionsspektren werden durch Gase bei niedrigen Temperaturen in der Nähe von Schriftarten kontinuierlicher Strahlung erzeugt. Gasatome oder Moleküle nehmen nur bestimmte Wellenlängen ab.
Das Wasserstoffemissionsspektrum
Das Wasserstoffemissionsspektrum ist besonders wichtig, da es das am häufigsten im gesamten Universum am häufigsten vorkommt und viele wichtige Informationen über die Sterne und die Milchstraße enthält.
Wasserstoffspektrumlinien wurden von verschiedenen Forschern entdeckt und jeweils benannt.
Balmer -Serie
Wasserstoff emittiert verschiedene Linien im sichtbaren Spektrum: Wenn das Elektron von Orbital 3 bis Orbital 2 abnimmt.6 nm, und wenn es von Orbital 4 bis 2 zerfällt, emittiert es 486 blaues Licht.1 nm.
 Wasserstoffemissionsspektrum, das die Linien zeigt, die sichtbarem Licht und zwei ultravioletten Linien links entsprechen. Quelle: Wikmedia Commons.
Wasserstoffemissionsspektrum, das die Linien zeigt, die sichtbarem Licht und zwei ultravioletten Linien links entsprechen. Quelle: Wikmedia Commons. 1885 (bevor Bohr seine Theorie vorschlug) fand der Mathematiker und Schweizer Professor Johann Balmer (1825-1898) eine Formel, um die Wellenlängen λ dieser Zeilen zu bestimmen:
Wo:
- R ist Rydbergs Konstante: 1.097 × 107 M-1
- N = 3, 4, 5 .. ., das heißt, n ≥ 3 (ganz).
Zum Beispiel für n = 3 in der Balmer -Gleichung:
Entsprechend der roten Linie nach rechts, dargestellt in der obigen Abbildung. Die Entdeckung der Balmer -Serie veranlasste andere Wissenschaftler, im Rest des Wasserstoffspektrums und anderer Gase nach Linien zu suchen.
Lyman -Serie
Beachten Sie, dass das in der Abbildung gezeigte Wasserstoffspektrum einige Linien in Ultraviolett enthält, die beiden der extremen linken, deren Wellenlängen 397 sind.0 nm und 388.9. nm.
In der Tat entsprechen diese Linien in Ultraviolett der SO -genannten Lyman -Serie, die 1906 vom Physiker Theodore Lyman entdeckt wurde. Seine Formel ist:
Kann Ihnen dienen: BTU (Wärmeeinheit): Äquivalenzen, Verwendungen, Beispiele)
Paschen -Serie
Die Paschen -Serie wurde 1908 vom deutschen Physiker Friederich Paschen entdeckt und gilt für n ≥ 4, dh n = 4, 5, 6 ..
Paschen -Linien finden sich im Bereich der nahen Infrarotregion und das endgültige Niveau ist n = 3, dh ihre Werte treten auf, wenn das Elektron von höheren Niveaus auf n = 3 abnimmt. Da die Lyman -Serie in Ultraviolett ist, wird der Schluss gezogen, dass die Balmer -Serie zwischen Lyman und Paschen ist.
Brackett -Serie
Diese Serie wurde 1922 von Frederick Brackett, einem amerikanischen Physiker, entdeckt und befindet sich im entfernten Infrarot und besteht aus den spektralen Linien, die den Wasserstoffübergängen entsprechen, die bei n = 5 beginnen und weitermachen:
PFund -Serie
Die PFUND -Serie wurde 1924 vom amerikanischen Physiker August Hermann Pfund gefunden und bezieht sich auf die Übergänge, die bei n = 5 im entfernten Infrarotband beginnen:
) Verweise
Verweise
- Arny, t. 2017. Erkundungen: Eine Einführung in die Astronomie. 8. Ed. McGraw Hill.
- Bauer, w. 2011. Physik für Ingenieurwesen und Wissenschaften. Band 2. Mc Graw Hill.
- Chang, R. 2013. Chemie. 11va. Auflage. MC Graw Hill Education.
- Sears, Zemansky. 2016. Universitätsphysik mit moderner Physik. 14. Ed. Band 2. Pearson.
- Fenster öffnen zum Universum. Die verschiedenen Arten von Spektren. Erholt von: Media4.OSPPM.fr.


)
m^-1=656.3&space;\:&space;nm)
)
)