Serineigenschaften, Funktionen, Stoffwechsel, Nahrung
- 2903
- 729
- Luca Holdt
Der Serin Es ist eine der 22 grundlegenden Aminosäuren, obwohl dies nicht als wesentliche Aminosäure für Menschen und andere Tiere klassifiziert wird.
Nach der Drei -Letter -Nomenklatur wird das Serin in der Literatur als (s im Einzelbuchstabencode) beschrieben. Diese Aminosäure beteiligt.
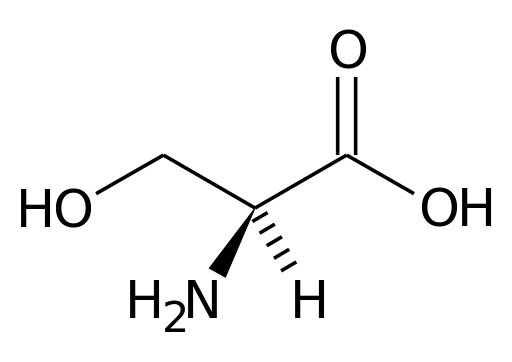
 Darstellung der Serie der Serin Aminosäure (Quelle: Pagezero darauf.Wikipedia [Public Domain] über Wikimedia Commons)
Darstellung der Serie der Serin Aminosäure (Quelle: Pagezero darauf.Wikipedia [Public Domain] über Wikimedia Commons) Viele wichtige Enzyme für Zellen haben viel.
Der Serin unter vielen seiner Funktionen nimmt als Vorläufer- und Gerüstmolekül an der Biosynthese anderer Aminosäuren wie Glycin und Cystein teil und ist Teil der Struktur der Sphingolipide, die in Zellmembranen in Zellmembranen vorhanden sind.
Die Serinsynthesequote variiert in jedem Organ und ändert sich außerdem entsprechend dem Entwicklungsstadium, in dem das Individuum ist.
Wissenschaftler haben vorgeschlagen, dass die L-Serin-Konzentrationen im Gehirngewebe mit dem Alter zunehmen, da die Permeabilität der Blutzellenbarriere im Gehirn des Erwachsenen abnimmt und schwere Hirnstörungen verursachen kann.
Es ist bekannt, dass L-serin für die Biosynthese von Neurotransmitter, Phospholipiden und anderen komplexen Makromolekülen von entscheidender Bedeutung ist, da es die Vorläufer für diese mehreren Stoffwechselwege liefert.
Verschiedene Studien haben gezeigt, dass die Versorgung mit Nahrungsergänzungsmitteln oder Konzentraten von L-serin an bestimmte Arten von Patienten die Glukose-Homöostase, die mitochondriale Funktion und die Verringerung der neuronalen Tod verbessern und den neuronalen Tod verringert.
[TOC]
Eigenschaften und Struktur
Alle Aminosäuren haben als Basisstruktur eine Carboxylgruppe und eine Aminogruppe, die an dasselbe Kohlenstoffatom gebunden ist. Diese unterscheiden sich jedoch von ihren Seitenketten, die als R -Gruppen bezeichnet werden und die in ihrer Größe, Struktur und sogar in ihrer elektrischen Ladung variieren können
Das Serin enthält drei Kohlenstoffatome: ein United Central Carbon einerseits zu einer Carboxylgruppe (COOH) und andererseits eine Amino -Gruppe (NH3+). Die beiden anderen zentralen Kohlenstoffbindungen werden von einem Wasserstoffatom und einer CH2OH -Gruppe (Gruppe R) besetzt, die für das Serin charakteristisch ist.
Der zentrale Kohlenstoff, zu dem die Amino- und Carboxylgruppen der Aminosäuren als α -Kohlenstoff bezeichnet werden. Die anderen Kohlenstoffatome von R -Gruppen sind mit den Buchstaben des griechischen Alphabets ausgewiesen.
Im Fall des Serins zum Beispiel ist das einzige Kohlenstoffatom in seiner R -Gruppe, das mit der OH -Gruppe verbunden ist, als Kohlenstoff γ bekannt.
Kann Ihnen dienen: Phosphatidilserin: Struktur, Synthese, Funktionen, OrtEinstufung
Das Serin wird innerhalb der Gruppe der polaren Aminosäuren ohne Last klassifiziert. Die Mitglieder dieser Gruppe sind sehr lösliche Aminosäuren in Wasser, dh sie sind hydrophile Verbindungen. In Serin und Treonin ist die Hydrophilie auf die Fähigkeit zurückzuführen, Wasserstoffbrücken mit Wasser durch seine Hydroxylgruppen zu bilden (OH).
In der Gruppe der polaren Aminosäuren ohne Last werden Cystein, Asparagin und Glutamin ebenfalls zusammengefasst. All dies hat eine polare Gruppe in ihrer R -Kette. Diese Gruppe ist jedoch nicht ionisierbar und pH -Wert nahezu der Neutralität, die ihre Gebühren aufnimmt, die eine Verbindung in Form von "erzeugen" “Zwitterion".
Stereochemie
Die allgemeine Asymmetrie von Aminosäuren macht die Stereochemie dieser Verbindungen von entscheidender Bedeutung in den Stoffwechselrouten, an denen sie teilnehmen. Im Falle des Serins kann dies als D-O l-serin gefunden werden.
Die α -Kohlenstoffe der Aminosäuren sind chirale Kohlenstoffe, da sie vier verschiedene Vereinigte Substituenten haben, was erzeugt, dass es mindestens zwei unterscheidbare Stereoisomere für jede Aminosäure gibt.
Ein Stereoisomer ist ein Spiegelbild eines Moleküls, das heißt, Sie können sich nicht übereinander überlappen. Die Lösungen dieser Aminosäuren drehen die polarisierte Lichtebene in entgegengesetzte Richtungen in entgegengesetzte Richtungen werden mit dem Buchstaben d o bezeichnet, das experimentell ist.
Das in Nervensystemzellen synthetisierte L-Serin dient als Substrat zur Synthese von Glycin oder D-Serin. Das D-Serin ist eines der wichtigsten Elemente für den Austausch von Vesikeln zwischen Neuronen. Einige Autoren schlagen daher vor, dass beide Serinisoformen in Wirklichkeit wesentliche Aminosäuren für Neuronen für Neuronen sind.
Funktionen
Die OH -Gruppe des Serins in seiner R -Kette R macht es zu einem guten Nucleophil, daher ist sie der Schlüssel zur Aktivität vieler Enzyme mit Serin in seinen aktiven Stellen. Serin ist eine der notwendigen Substrate für die Synthese von NADPH und Glutathion -Nukleotid.
Die L-Serie ist für die Entwicklung und das ordnungsgemäße Funktionieren des Zentralnervensystems unverzichtbar. Studien haben gezeigt, dass die exogene Versorgung von L-serin in niedrigen Dosen an Hippocampus-Neuronen und Purkinje-Zellen In vitro, Verbessert Ihr Überleben.
Mehrere Studien von Krebszellen und Lymphozyten haben festgestellt, dass für die übermäßige Nukleotidproduktion sowie für die anschließende Proliferation von Krebszellen serinabhängige Kohlenstoffeinheiten erforderlich sind.
Kann Ihnen dienen: microbiota: Komposition, Funktionen und wo ist esSelenocystein ist Teil der 22 grundlegenden Aminosäuren und wird nur als Derivat des Serin erhalten. Diese Aminosäure wurde nur in einigen Proteinen beobachtet, enthält Selen anstelle von Schwefel, die an das Cystein gebunden sind, und wird basierend auf einem sterifizierten Serin synthetisiert.
Biosynthese
Das Serin ist eine nicht essentielle Aminosäure, da sie vom menschlichen Körper synthetisiert wird. Dies kann jedoch hauptsächlich durch die Ernährung verschiedener Quellen wie Proteine und Phospholipide assimiliert werden.
Das Serin wird in seiner Form durch Umwandlung eines Glycinmoleküls synthetisiert, eine Reaktion, die durch ein Hydroxymethyltransferase-Enzym vermittelt wird.
Es ist bekannt, dass der Hauptort der Synthese von L-Serin in Astrozyten und nicht in Neuronen liegt. Es sind diese Zellen, Synthese erfolgt durch einen Phosphorylierungsweg.
Drei Enzyme wirken auf diesen Weg: die 3-phosphoglycerate Dehydrogenase, Phosphoserin-Transferase und Phosphoserin-Phosphatase.
Andere wichtige Organe in Bezug auf die Serinsynthese sind Leber, Nieren, Hoden und Milz. Die Enzyme, die Serin synthetisieren.
Eine der ersten Syntheserouten des bekannten Serin. Der Beitrag dieses Weges zur Produktion von Körper Serin ist jedoch gering.
Stoffwechsel
Es ist derzeit bekannt. Dank eines Transaminierungsprozesses zwischen 3-Hydroxi-Pyruvinsäure und Alanin wird Serin hergestellt.
Experimente mit Ratten, die radioaktiv Kohlenstoff 4 von Glucose markieren.
In Bakterien ist das L-serin-Desaminase-Enzym das Hauptenzym, das für die Metabolisierung des Serins zuständig ist: Es wandelt L-serin in ein Pyruvat um. Es ist bekannt, dass dieses Enzym in Pflanzen von vorhanden und aktiv ist UND. coli Erteilung in minimalen Medien mit Glukose.
Es ist nicht sicher bekannt Andere, so folgt es, dass es wichtige physiologische Auswirkungen haben muss.
Kann Sie dienen: Dryopithecus: Entdeckung, Eigenschaften, Schädel, EssenSell reichhaltige Lebensmittel
Alle Lebensmittel mit hohen Proteinkonzentrationen sind reich an Serin, hauptsächlich Eier, Fleisch und Fisch. Dies ist jedoch eine nicht essentielle Aminosäure, daher ist es angesichts der Tatsache, dass der Körper sie selbst synthetisieren kann, nicht unbedingt erforderlich, sie aufzunehmen.
Einige Menschen leiden unter einer ungewöhnlichen Störung, da sie einen Mangelphänotyp in Bezug auf die Synthesemechanismen von Serin und Glycin haben. Daher müssen sie konzentrierte Nahrungsergänzungsmittel für beide Aminosäuren aufnehmen.
Darüber hinaus bieten kommerzielle Marken, die auf den Verkauf von Vitamin-Nahrungsergänzungsmitteln (Lamberts, jetzt Sport und Holomega) spezialisiert sind.
Verwandte Krankheiten
Die Fehlfunktion der an der Biosynthese des Serin beteiligten Enzyme kann schwerwiegende Pathologien verursachen. Durch die Verringerung der Serinkonzentration in Blutplasma und Cerebrospinalflüssigkeit kann es Hypertonie, psychomotorische Verzögerung, Mikrozephalie, Epilepsie und komplexe Erkrankungen des Zentralnervensystems verursachen.
Derzeit wurde festgestellt, dass der Serinmangel an der Entwicklung von Diabetes mellitus beteiligt ist, da L-serin für die Synthese von Insulin und die der Rezeptoren erforderlich ist.
Babys, die Defekte in der Serinbiosynthese präsentieren.
Verweise
- Elsila, j. UND., Dworkin, J. P., Bernstein, m. P., Martin, m. P., & Sandford, s. ZU. (2007). Mechanismen der Aminosäurebildung in interstellaren Eisanaloga. Das Astrophysical Journal, 660 (1), 911.
- Ichord, r. N., & Bearden, D. R. (2017). Perinatale metabolische Enzephalopathien. In Swaimans pädiatrischer Neurologie (pp. 171-177). Elsevier.
- Mothet, j. P., Elternteil, a. T., Wolosker, h., Brady, r. ENTWEDER., Linden, d. J., Ferris, c. D.,… & Snyder, s. H. (2000). D-Serin ist ein endogener Ligand für die Glycinstelle des N-Methyl-D-AP-AP-A-Apartat-Empfängers. Proceedings der National Academy of Sciences, 97 (9), 4926-4931
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehninger Prinzipien der Biochemie. Macmillan.
- Rodríguez, a. UND., Ducker, g. S., Billingham, l. K., Martinez, c. ZU., Mainolfi, n., Suri, v.,… & Chandel, n. S. (2019). Serinstoffwechsel unterstützt die Makrophagen-IL-1β-Produktion. Zellstoffwechsel, 29 (4), 1003-1011.
- Tabatabaie, l., Klomp, l. W., Berger, r., & Koning, t. J. (2010). L-serin-Synthese im Zentralnervensystem: Eine Überprüfung zu Serinmangelerkrankungen. Molekulare Genetik und Metabolismus, 99 (3), 256-262.
- « Glyceraldehydstruktur, Eigenschaften, Funktionen
- Zinkgeschichte, Eigenschaften, Struktur, Risiken, verwendet »

