Siliziumgeschichte, Eigenschaften, Struktur, erhalten, verwendet, verwendet

- 4625
- 608
- Ivan Pressler
Er Silizium Es ist ein nicht -metallisches Element und gleichzeitig Metalloid, das durch das chemische Symbol dargestellt wird, wenn. Es ist ein Halbleiter, der ein wesentlicher Bestandteil von Computern, Taschenrechnern, Mobiltelefonen, Solarzellen, Dioden usw. ist.; Es ist praktisch die Hauptkomponente, die die Siedlung der digitalen Ära ermöglicht hat.
Silizium war schon immer in Quarz und Silikat. Es ist somit das zweithäufigste Element auf der Erdoberfläche, und die Weite der Wüsten und Strände bietet eine Perspektive, wie reichlich es ist.
 Wüsten sind eine reichhaltige natürliche Quelle von Silica -Partikeln oder Graniten mit anderen Mineralien. Quelle: pxhere.
Wüsten sind eine reichhaltige natürliche Quelle von Silica -Partikeln oder Graniten mit anderen Mineralien. Quelle: pxhere. Das Silizium gehört zu Gruppe 14 der Periodenzüchtertabelle, genau wie Carbon darunter, darunter. Deshalb wird dieses Element als Tetravalent -Metalloid angesehen; Es hat vier Elektronen Valencia und theoretisch können Sie sie alle verlieren, um das Kation zu bilden, wenn4+.
Eine Eigenschaft, die mit Kohle teilt, ist die Fähigkeit, verkettet zu werden. Das heißt, ihre Atome sind kovalent mit der Definition von Molekülketten verbunden. Ebenso kann Silizium seine eigenen "Kohlenwasserstoffe" bilden, die als Siltans bezeichnet werden.
Die vorherrschenden Siliziumverbindungen in der Natur sind die berühmten Silikate. In seiner reinen Form kann es als solide monokristallin, polyristalin oder amorph auftreten. Es ist ein relativ träge Feststoff, daher ist es keine erheblichen Risiken dar.
[TOC]
Geschichte
Der Siliziumstein
Silizium ist vielleicht eines der Elemente, das den größten Einfluss auf die Geschichte der Menschheit hatte.
Dieses Element ist der Protagonist der Steinzeit und auch der digitalen Ära. Ihre Ursprünge stammen aus, als Zivilisationen mit Quarz zusammengearbeitet und ihr eigenes Glas hergestellt wurden. Und derzeit ist es die Hauptkomponente von Computern, Laptops und Smartphones.
Praktisch Silizium war der Stein von zwei Epochen, die in unserer Geschichte klar definiert wurden.
Isolation
Als die Siliciumdioxid so reichlich vorhanden war, musste ein Name aus dem Flint -Felsen ein extrem reiches Element in der Erdkruste enthalten. Dies war der erfolgreiche Verdacht von Antoine Lavoizier, der 1787 bei ihren Versuchen, es aus ihrem Oxid zu reduzieren.
Einige Zeit später machte Humphry Davy 1808 seine eigenen Versuche und wandte dem Element seinen Vornamen zu: 'Silicium', das übersetzt wäre wie 'pedernales Metall' '. Das heißt, das Silizium wurde bis dahin aufgrund seiner mangelnden Charakterisierung als Metall angesehen.
Dann, 1811 die französischen Chemiker Joseph L. Gay-Lussac und Louis Jacques Thénard haben es geschafft, amorphes Silizium zum ersten Mal vorzubereiten. Dafür reagierten sie Siliziumtetrafluorid mit metallischem Kalium. Sie haben das erhaltene Produkt jedoch nicht gereinigt oder charakterisiert, sodass sie nicht zu dem Schluss gekommen sind, dass es das neue Silicium -Element war.
Es war nichts als im Jahr 1823, als der schwedische Chemiker Jacob Berzelius ein amorphes Silizium mit ausreichender Reinheit erhielt, um es als Silizium zu erkennen; Name des schottischen Chemikers Thomas Thomson im Jahr 1817, als es ein nicht -metallisches Element betrachtet. Berzelius führte die Reaktion zwischen Kalium und geschmolzenem Kaliumfluorosilikat durch, um dieses Silizium zu produzieren.
Kristallines Silizium
Das kristalline Silizium wurde 1854 zum ersten Mal vom französischen Chemiker Henry Deville zubereitet. Um dies zu erreichen, machte Deville eine Elektrolyse einer Mischung aus Aluminium- und Natriumchloriden, wodurch Siliziumkristalle erhalten wurden, die von einer Schicht aus Aluminium siliciuro bedeckt sind, die sie (anscheinend) mit Wasser mit Wasser waschen (mit Wasser.
Physikalische und chemische Eigenschaften
Aussehen
 Elementares Silizium mit einem metallischen Glanz, aber es ist tatsächlich ein Metalloid. Quelle: Hi-Res-Bilder chemischer Elemente [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)]]
Elementares Silizium mit einem metallischen Glanz, aber es ist tatsächlich ein Metalloid. Quelle: Hi-Res-Bilder chemischer Elemente [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)]] Das Silizium in seiner reinen oder elementaren Form besteht aus einem bläulich grauen oder schwarzen Feststoff (überlegenes Bild), das zwar kein Metall ist, helle Gesichter, als ob es wirklich wäre.
Es ist ein harter, aber spröder Feststoff, der auch eine Plattenepitheloberfläche aufweist, wenn es von Polyristales gebildet wird. Andererseits sieht amorphes Silizium aus wie ein dunkelbrauner Pulverfest. Dank diesem ist es leicht, eine Art von Siliziumtyp (kristallin oder polyristalin) von einem anderen (amorph) zu identifizieren und zu differenzieren.
Molmasse
28.085 g/mol
Atomnummer (z)
14 (14Ja)
Schmelzpunkt
1414 ºC
Siedepunkt
3265 ºC
Dichte
-Bei Raumtemperatur: 2,33 g/ml
-Direkt am Schmelzpunkt: 2,57 g/ml
Beachten Sie, dass flüssiges Silizium dichter ist als festes Silizium; Das bedeutet, dass ihre Kristalle in einer flüssigen Phase schweben, wie beim Eiswassersystem. Die Erklärung ist auf die Tatsache zurückzuführen, dass der interatomische Raum zwischen den Atomen in seinem Glas größer (weniger dicht) ist als der entsprechende in der Flüssigkeit (Denser).
Fusionshitze
50,21 kJ/mol
Verdampfungswärme
383 kJ/mol
Molarenwärmekapazität
19.789 j/(mol · k)
Elektronegativität
1,90 auf der Paulingskala
Ionisationsenergien
-Erstens: 786,5 kJ/mol
-Zweitens: 1577.1 kJ/mol
-Dritter: 3231.6 kJ/mol
Atomradio
111 Uhr (gemessen in ihren jeweiligen Diamantkristallen)
Wärmeleitfähigkeit
149 w/(m · k)
Elektrischer widerstand
2.3 · 103 Ω · m bis 20 ° C
Mohs Härte
6.5
Verkettung
Siliziumatome haben die Fähigkeit, einfache Si-Si-Glieder zu bilden, die am Ende eine Kette definieren (Si-Si-Si ...).
Diese Eigenschaft manifestiert sich auch in Kohlenstoff und Schwefel; SP -Hybridisierungen jedoch3 des Siliziums sind im Vergleich zu den beiden anderen Elementen mangelhafter, und außerdem sind ihre 3p -Orbitale diffuser, sodass sich die Überlappung der Orbitale SP3 Resultierende ist schwächer.
Kann Ihnen dienen: exotherme und endotherme ReaktionenDie durchschnittlichen Energien der kovalenten SI-Si- und C-C-Bindungen betragen 226 kJ/mol bzw. 356 kJ/mol. Daher sind sii-Wenn-Verbindungen schwächer. Aus diesem Grund ist Silizium weder der Eckpfeiler des Lebens (noch Schwefel). In der Tat ist die längste Kette oder das längste Skelett, das sich Silizium bilden kann, normalerweise vier Mitglieder (wenn4).
Oxidationszahlen
Das Silizium kann eine der folgenden Oxidationszahlen haben, vorausgesetzt in jedem von ihnen die Existenz der Ionen mit ihren jeweiligen Lasten: -4 (Ja4-), -3 (ja3-), -2 (ja2-), -1 (ja-), +1 (ja+), +2 (ja2+), +3 (ja3+) und +4 (ja4+). Von allen sind die -4 und +4 die wichtigsten.
Zum Beispiel wird -4 in Siliciuros (mg) angenommen2Ja oder Mg22+Ja4-); während +4 der von Siliciumdioxid (sio) entspricht2 oder wenn4+ENTWEDER22-).
Reaktivität
Silizium ist in Wasser sowie starke Säuren oder Basen völlig unlöslich. Es löst sich jedoch in einer konzentrierten Mischung aus Stellschrick- und Fluorhorhoriksäuren (HNO3-Hf). Ebenso löst es sich in einer heißen alkalischen Lösung auf, wobei die folgende chemische Reaktion auftritt:
Ja (s) + 2naoh (ac) + h2Oder (l) => na2Siio3(Ac) + 2h2(G)
Das Natriummetasilikat, na2Siio3, Es wird auch gebildet, wenn sich Silizium in geschmolzenem Natriumcarbonat auflöst:
Ja (s) + na2CO3(L) => na2Siio3(L) + c (s)
Bei Raumtemperatur reagiert es überhaupt nicht mit Sauerstoff, nicht einmal bei 900 ° C, wenn sich eine Siio -schützende Glaskörperschicht bildet2; Und dann reagiert das Silizium bei 1400 ° C mit dem Luftstickstoff, um eine Mischung aus Nitrhüren zu bilden, ohne und wenn3N4.
Silizium reagiert auch bei hohen Temperaturen mit Metallen zu Metall Siliciuros:
2 mg (s) + Ja (s) => mg2Ja (s)
2cu (s) + yes (s) => cu2Ja (s)
Bei Raumtemperatur reagiert es explosiv und direkt mit Halogenen (es gibt keine SiO -Schicht2 das schützt es davor). Zum Beispiel haben Sie die SIF -Formationsreaktion4:
Ja (s) + 2f2(g) => sif4(G)
Und obwohl Silizium im Wasser unlöslich ist, reagiert Red Alive mit einem Dampfstrom:
Ja (s) + h2Oder (g) => Si2(s) + 2h2(G)
Elektronische Struktur und Konfiguration
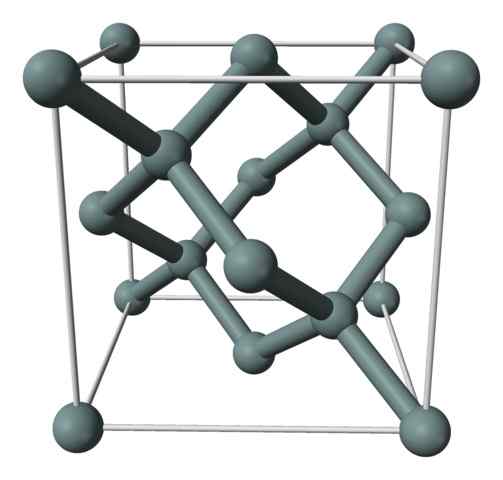 Kristalline Struktur oder die einheitliche Zelle des Siliziums, die mit einem Modell von Kugeln und Stäben dargestellt wird. Quelle: Benjah-BMM27 [Public Domain]
Kristalline Struktur oder die einheitliche Zelle des Siliziums, die mit einem Modell von Kugeln und Stäben dargestellt wird. Quelle: Benjah-BMM27 [Public Domain] Das obere Bild zeigt die Kubikstruktur, die auf den Gesichtern (FCC), die wie das des Diamanten, für Siliziumkristall zentriert ist. Die grauen Kugeln entsprechen den Atomen, wenn sie, wie geschätzt, kovalent miteinander verbunden sind; Außerdem haben sie tetraedrische Umgebungen, die sich entlang des Glas vermehren.
Der Siliziumkristall ist FCC, weil ein Atom beobachtet wird, wenn sie sich auf jedem der Gesichter des Würfels befinden (6 × 1/2). Es gibt auch acht Atome, wenn sich in den Eckpunkten des Würfels (8 × 1/8) und vier darin befinden (diejenigen, die ein gut definiertes Tetraeder um sie herum zeigen, 4 × 1).
In der oben genannten Einheitszelle hat jede Einheitszelle insgesamt acht Siliziumatome (3 + 1 + 4, in dem obigen Absatz angegeben); Merkmal, das dazu beiträgt, seine hohe Härte und Starrheit zu erklären, da reines Silizium sowohl ein kovalenter Kristall als auch Diamant ist.
Kovalenter Charakter
Dieser kovalente Charakter beruht auf der Tatsache, dass Silizium wie Kohlenstoff gemäß seiner elektronischen Konfiguration vier Valenzelektronen hat:
[Ne] 3s2 3p2
Um zu verknüpfen, sind reine Orbitale 3s und 2p nutzlos. Deshalb erzeugt das Atom vier SP -Hybridorbitale3, Mit denen Sie vier Si-Si-kovalente Bindungen bilden können und auf diese Weise den Oktett von Valencia für die beiden Siliziumatome vervollständigen.
Der Siliziumkristall wird dann als kovalentes und dreidimensionales Netzwerk visualisiert, das aus miteinander verbundener Tetraeder besteht.
Dieses Netzwerk ist jedoch nicht perfekt, da es Mängel und Korngrenzen vorstellt, die einen Kristall von einem anderen trennen und definieren; Und wenn solche Kristalle sehr klein und zahlreich sind, wird von einem polyristalen Feststoff die Rede sein, das durch seine heterogene Helligkeit identifiziert wird (ähnlich wie ein betrogenes Mosaik- oder Oberflächensilber).
Elektrische Leitfähigkeit
SI-IF-Verbindungen mit ihren gut gelegenen Elektronen sind im Prinzip nicht mit dem, was von einem Metall erwartet wird: ein Meer von Elektronen "benetzen" ihre Atome; Zumindest ist dies bei Raumtemperatur so.
Wenn die Temperatur zunimmt, beginnt Silizium den Strom zu treiben und verhält sich daher wie ein Metall; Das heißt, es ist ein Halbleiter -Metalloidelement.
Amorphes Silizium
Siliziumtetraheder nehmen nicht immer ein strukturelles Muster an, sondern können auf ungeordnete Weise angeordnet werden. Und sogar mit Siliziumatomen, deren Hybridisierungen scheinbar SP zu sein scheinen3 aber sp2, was dazu beiträgt, den Grad der Störung weiter zu erhöhen. Daher ist die Rede von einem amorphen und nicht kristallinen Silizium.
Im amorphen Silizium gibt es elektronische offene Stellen, bei denen einige ihrer Atome ein Orbital mit einem Elektron verschwinden. Dank dessen kann sein Feststoff Wasserstoff selbst Wasserstoff selbst zur Bildung von hydrogenem amorphem Silizium entstehen. Das heißt.
Kann Ihnen dienen: Interatomische LinksDieser Abschnitt wird dann mit der Begründung des Siliziums in drei Arten von Feststoffen (ganz zu schweigen von seinem Reinheit) abgeschlossen: Kristalline, Polyristalin und Amorph.
Jeder von ihnen hat eine eigene Methode oder einen eigenen Produktionsprozess sowie seine Anwendungen und sein Dilemma.
Wo ist es und erhalten
 Quarzkristalle (Kieselsäure) sind eine der wichtigsten und außergewöhnlichsten Mineralien, in denen sich Silizium befindet. Quelle: James st. John (https: // www.Flickr.com/fotos/jsjgeology/22437758830)
Quarzkristalle (Kieselsäure) sind eine der wichtigsten und außergewöhnlichsten Mineralien, in denen sich Silizium befindet. Quelle: James st. John (https: // www.Flickr.com/fotos/jsjgeology/22437758830) Silizium ist das siebstreichste Element des Universums und der zweite in der Erdkruste, das auch den Mantel der Erde mit seiner riesigen Mineralienfamilie bereichert. Dieses Element ist außerordentlich gut mit Sauerstoff verbunden und bildet eine Vielzahl von Oxiden. Unter ihnen, Silica, so2, und Silikate (verschiedene chemische Zusammensetzung).
Kieselsäure ist mit dem bloßen Auge in den Wüsten und Stränden zu sehen, da der Sand hauptsächlich aus SiO besteht2. Dieses Oxid kann sich wiederum in einigen Polymorphen manifestieren, die am häufigsten sind: Quarz, Amethyst, Achat, Christobalit, Tripolis, Coesit, Stishovita und Thundimita. Darüber hinaus kann es in amorphen Feststoffen wie Opalen und Diatomea -Ländern gefunden werden.
Die Silikate sind inzwischen strukturell und chemisch noch reicher. Unter einigen der Silikate Mineralien können erwähnt werden: Asbest (weiß, kaffee und bläulich), Feldspat, Ton, Mykien, Oliven, Aluminosilikate, Zeolithen, Amphibe und Pyroxene.
Praktisch bestehen alle Gesteine aus Silizium und Sauerstoff mit ihren si-o-stabilen Bindungen und ihren Silikaten und Silikaten, gemischt mit Metalloxiden und anorganischen Spezies.
-Kieselreduzierung
Das Problem, das sich darstellt, Silizium zu erhalten. Der Rohstoff für diesen Prozess ist quarz -verdrängter Kieselsäure, das sich zuvor bewegt, bis es ein feines Pulver ist.
Aus diesem Boden kann es entweder durch amorphes Silizium oder Polyristalin hergestellt werden.
Amorphes Silizium
In kleinem Maßstab, das in einem Labor und mit den relevanten Maßnahmen hergestellt wird. Die nächste Reaktion findet dann statt:
Siio2(s) + mg (s) => 2mgo (s) + yes (s)
Magnesium und Oxid werden mit einer verdünnten Salzsäurelösung beseitigt. Dann wird der verbleibende Feststoff mit Fluorhorsäure behandelt, so dass er die SIO reagiert2 im Übermaß; Ansonsten begünstigt überschüssiger Magnesium die Bildung seines jeweiligen Siliciuro, MG2Ja, unerwünschte Verbindung für den Prozess.
Der Sio2 Es verwandelt sich in SIF -flüchtiges Gas4, die für andere chemische Synthese gewonnen wird. Schließlich wird der amorphe Siliziumteig unter einem Gaswasserstoffstrom getrocknet.
Eine weitere ähnliche Methode, um amorphes Silizium zu erhalten, besteht darin, dasselbe SF zu verwenden4 zuvor produziert oder die SICL4 (zuvor erworben). Die Dämpfe dieser Silizium -Halogenuros werden in einer träge Atmosphäre über flüssiges Natrium geleitet, so dass die Verringerung von Gas ohne Sauerstoff vorhanden ist:
Sicl4(g) + 4na (l) => Ja (s) + 4naCl (l)
Interessanterweise werden mit amorphem Silizium Solarmodule mit hoher Energieleistung hergestellt.
Kristallines Silizium
Beginnend von der Pulverkiesel oder dem Quarz werden sie in einen elektrischen Bogenofen gebracht, wo es mit Koks reagiert. Auf diese Weise ist das Reduktionsmittel kein Metall mehr, sondern ein kohlenstoffhaltiges Material mit hoher Reinheit:
Siio2(s) + 2c (s) => Ja (s) + 2co (g)
In der Reaktion wird auch Siliziumkarbid produziert, sic, das mit einem Überschuss an SiO neutralisiert wird2 (Wieder ist der Quarz übermäßig):
2sic (s) + sio2(s) => 3SI (s) + 2co (g)
Eine andere Methode zur Herstellung von kristallinen Silizium besteht darin, Aluminium als Reduktionsmittel zu verwenden:
3sio2(s) + 4al (l) => 3SI (s) + 2al2ENTWEDER3(S)
Und ab dem Kaliumhexafluorurosilicat, k2[Sif6] Es wird auch mit Metallaluminium oder Kalium umgesetzt, um dasselbe Produkt zu verursachen:
K2[Sif6] (l) + 4al (l) => 3SI (s) + 6kf (l) + 4ALF3(G)
Sofort löst sich das Silizium in geschmolzenem Aluminium auf, und wenn das System abkühlt, kristallisiert sich die erste und trennt sich von der zweiten; Das heißt, Siliziumkristalle werden gebildet, die graue Farben aussehen.
Polyristalines Silizium
Im Gegensatz zu der anderen Synthese oder Produktionen beginnt es mit einer Silano -Gasphase SIH mit einer Silano -Gasphase4. Dieses Gas erfährt eine Pyrolyse über 500 ° C, so dass eine thermische Zersetzung auftritt und damit ihre anfänglichen Dämpfe die Siliziumpolyristen auf einer Halbleiteroberfläche ablegen.
Die folgende chemische Gleichung veranschaulicht die Reaktion, die stattfindet:
Ja h4(g) => Ja (s) + h2(G)
Offensichtlich sollte es keinen Sauerstoff in der Kammer geben, wie es mit dem SIH reagieren würde4:
Ja h4(g) + 2nd2(g) => sio2(s) + 2h2O (g)
Und die Spontaneität der Verbrennungsreaktion ist solche, die schnell bei Raumtemperatur im Gesicht auftritt.
Ein weiterer synthetischer Weg, um diese Art von Siliziumteil des kristallinen Siliziums als Rohstoff zu erzeugen. Sie reagieren mit Wasserstoffchlorid bei einer Temperatur bei 300 ° C, so dass sich die Trichlorosilano gebildet hat:
Kann Ihnen dienen: Eisen (Element): Eigenschaften, chemische Struktur, verwendetJa (s) + 3HCl (g) => sicl3H (g) + h2(G)
Und die Sicl3H reagiert auf 1100 ° C, um Silizium zu regenerieren, aber jetzt polyristalin:
4sicl3H (g) => Ja (s) + 3sicl4(g) + 2h2(G)
Es reicht aus, die Gleichungen zu sehen, um eine Vorstellung von Arbeit und strengen Produktionsparametern zu geben, die berücksichtigt werden müssen.
Isotope
Silizium ist natürlich und hauptsächlich als Isotop 28Ja, mit einer Fülle von 92,23%.
Darüber hinaus gibt es zwei andere Isotope, die stabil sind und daher nicht radioaktiver Zerfall erleiden: die 29Ja, mit einer Fülle von 4,67%; Und 30Ja, mit einer Fülle von 3,10%. So reichlich vorhanden sein 28Ja, es ist nicht verwunderlich, dass das Atomgewicht des Siliziums 28.084 u beträgt.
Das Silizium kann auch in mehreren Radioisotopen sein, darunter die 31Ja (T1/2= 2,62 Stunden) und 32Ja (T1/2= 153 Jahre). Andere (22Ja - 44Wenn sie haben T1/2 Sehr kurz oder kurz (weniger als hundertstel Sekunden).
Risiken
Reines Silizium ist eine relativ inerte Substanz, so dass es sich normalerweise in keinem Organ oder Gewebe ansammelt, solange die Exposition davon niedrig ist. In Staubform kann es Augenreizungen verursachen, Tränen oder Rötungen verursachen und gleichzeitig die Hautbeschwerden, Juckreiz und Schälen verursachen können.
Wenn die Exposition sehr hoch ist, kann Silizium die Lunge verletzen; Ohne nachfolgende Auswirkungen, es sei denn, der Betrag reicht aus, um Erstickung zu verursachen. Dies geschieht jedoch nicht bei Quarz, das mit Lungenkrebs und Krankheiten wie Bronchitis und Emphysem verbunden ist.
Ebenso ist reines Silizium in der Natur sehr selten, und seine Verbindungen, die in der Erdkruste so reichlich vorhanden sind, stellen kein Risiko für die Umwelt dar.
In Bezug auf die Organe könnten diese nun giftig sein; Viele von ihnen hängen jedoch davon ab, welche als andere Faktoren berücksichtigt werden (Reaktivität, pH, Wirkungsmechanismus usw.).
Anwendungen
Baugewerbe
Siliziummineralien integrieren den "Stein", mit dem Gebäude, Häuser oder Denkmäler gebaut werden. Zum Beispiel bestehen Zemente, Beton, Stuck und feuerfeste Ziegel aus festen Gemischen, die auf Silikaten basieren. Aus diesem Ansatz kann man das Nutzen erscheinen, das dieses Element in Städten und Architektur hat.
Glas und Keramik
Aus den Siliciumdioxen können Kristalle, die auf optischen Geräten verwendet werden.
Wenn das Material mit mehreren Zusatzstoffen hergestellt wird, verwandelt es sich in einem amorphen Feststoff, bekannt als Glas; und Berge von Sand sind normalerweise die Quelle von Kieselsäure oder Quarz, die für die Produktion erforderlich sind. Andererseits werden mit den Silikaten Keramik- und Porzellanmaterialien hergestellt.
Silizium ist auch in Handwerk und Verzierungen vorhanden.
Legierungen
Siliziumatome können zusammenhängend und mit einer Metallmatrix mischbar sein, sodass es für zahlreiche Legierungen oder Metalle ein Additiv ist. Zum Beispiel Stahl zur Herstellung magnetischer Kerne; Bronzen für die Herstellung von Telefonkabeln; und Aluminium bei der Herstellung von Aluminium-Sailicio-Legierung für leichte Automobilteile.
Daher kann es nicht nur im "Stein" von Gebäuden gefunden werden, sondern auch in den Metallen ihrer Säulen.
Trockenmittel
 Gallertartige Kieselkugeln, die als Trockenmittel verwendet werden. Quelle: Trockenmittel [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Gallertartige Kieselkugeln, die als Trockenmittel verwendet werden. Quelle: Trockenmittel [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Siliciumdioxid in Form von Gel oder Amorph ermöglicht es, Feststoffe herzustellen, die als Trockenmittel fungieren.
Elektronische Industrie
 Für die Herstellung von Sonnenkollektoren werden polyristale und amorphe Silizium verwendet. Quelle: pxhere.
Für die Herstellung von Sonnenkollektoren werden polyristale und amorphe Silizium verwendet. Quelle: pxhere. Siliziumschichten verschiedener Dicke und Farben sind Teil von Computerchips sowie mit ihrem festen (kristallinen oder amorphen), integrierten Schaltkreisen und Solarzellen wurden entwickelt.
Als Halbleiter sind Atome mit weniger (AL, B, GA) oder mehr Elektronen (p, AS, SB) in einbezogen, um es in Typ -Halbleiter zu verwandeln P entweder N, bzw. Mit zwei Silicios -Gewerkschaften, einer N und der andere P, Dioden von Lichtemitter werden hergestellt.
Silikonpolymere
Der berühmte Silikonkleber besteht aus einem organischen Polymer, das durch die Stabilität der Ketten der Si-O-Si-Verbindungen unterstützt wird. Wenn diese Ketten sehr lang, kurz oder vernetzt sind, ändern sich die Eigenschaften des Silikonpolymers sowie ihre sowie ihre und ihre endgültige Anwendungen.
Unter seinen Verwendungen kann Folgendes nachstehend erwähnt werden:
-Kleber oder Klebstoffe, nicht nur, um Papiere, sondern auch Baublöcke, Gummi, Glasscheiben, Felsen usw. anzuschließen, usw.
-Schmiermittel in hydraulischen Bremssystemen
-Verstärkt die Gemälde und verbessert die Helligkeit und Intensität ihrer Farben gleichzeitig, um Temperaturänderungen zu widerstehen, ohne zu knacken oder zu carecome
-Sie werden als Wasserschutzsprays verwendet, das einige Oberflächen oder Gegenstände trocken bleibt
-Sie geben persönliche Hygieneprodukte (Zahnpasta, Shampoo, Gele, Rasiermessercremes usw.) Das Gefühl, seidig zu sein
-Seine Beschichtungen schützen die elektronischen Komponenten empfindlicher Geräte vor Wärme und Luftfeuchtigkeit, wie z. B. Mikroprozessoren
-Mit Silikonpolymeren werden einige der Sprungkugeln kaum auf den Boden fallen gelassen.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Silizium. Abgerufen von: in.Wikipedia.Org
- Mikrochemikalien. (S.F.). Kristallographie von Silizium. Erholt von: Mikrochemikalien.com
- Lentech b.V. (2019). Periodentisch: Silizium. Erholt von: lentech.com
- Marques Miguel. (S.F.). Silizium tritt auf. Geborgen von: nautilus.Fis.UC.Pt
- Mehr Hemant. (5. November 2017). Silizium. Erholt von: Hemantmore.Org.In
- Pilgaard Michael. (22. August 2018). Silizium: Auftreten, Isolation und Synthese. Erholt von: Pilgaargs.com
- DR. Doug Stewart. (2019). Siliziumelement -Fakten. Chemicool. Erholt von: Chemicoolool.com
- Christiana Honsberg und Stuart Bowden. (2019). Eine Sammlung von Ressourcen für den Photovoltaik -Pädagogen. Pvedukation. Abgerufen von: pveducation.Org
- American Chemistry Council, Inc. (2019). Silikone im Alltag. Erholt von: SEHSC.Americachemistry.com

