Syncitiotrophoplasteneigenschaften, Funktion, Plazenta -Apoptose
- 5112
- 41
- Said Ganzmann
Er Synkitotophoblasten Es handelt. Diese Zellschicht dringt während der embryonalen Entwicklung von Säugetieren in das Epithel und Stroma des Endometriums ein. Die Zellen, die machen.
Diese Zellschicht stammt aus der Zelldifferenzierung von Cytotrophoblasten und ist für den Austausch von Gasen und Nährstoffen zwischen Mutter und Fötus verantwortlich. Darüber hinaus kann es in der Implantationsphase der Blastozyste zum Endometrium und in der Bildung der Plazenta Hormone und Peptide produzieren.
 Quelle: Henry Vandyke Carter [Public Domain] [TOC]
Quelle: Henry Vandyke Carter [Public Domain] [TOC]
Eigenschaften
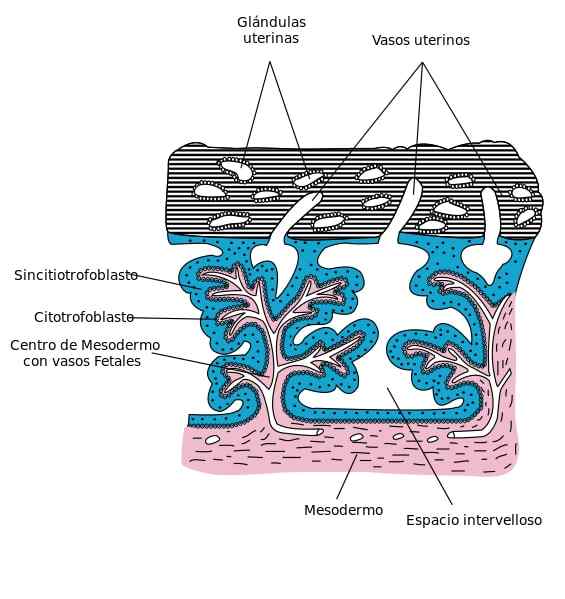
Wie der Name schon sagt, haben die Syncitiotrophoblastenzellen ihre Membranen verloren und verschmolzen, was dieser zellulären Schicht ein multinuklesiertes Erscheinungsbild des syncitiellen Typs verleiht.
Diese Zell.
Sympitiotrophoblasten stammt aus der Proliferation und Fusion von Cytotrophoblastenzellen. Die Zellen dieser Schicht haben keine proliferative Kapazität, dh sie leiden nicht mit Mitose, so.
Diese Zellen haben Golgi -Komplexe und reichlich.
Diese Zellschicht hat auch eine sekretorische Funktion, die Progesteron, Östrogen, humane Choriongonadotropin (HCG) und Laktogene freigibt. Wenn das zelluläre Material abfällt.
Funktion in der embryonalen Entwicklung
Verschachtelung oder Implementierung
Das Blastozyten bindet an das Endometrium, das ein Stadium der schnellen Zellproliferation startet, wobei die Differenzierung von Trophoblasten in Cytotrophoblasten und Syncitiotrophoblaste startet. Letzteres erstreckt sich durch das Epithel des Endometriums, bis er seinen Strom erreicht hat.
Kann Ihnen dienen: KeratinozytenDiese entscheidenden Zellen leiden degenerativ.
Sobald die Blastozyste zum Endometrium durch den Implementierung oder den Nistprozess implantiert wird, führt die Fusion der äußersten Zellen des Trophoblasten zu der primitiven Synkitiotrophoblasten.
Anschließend werden Lagunen gebildet, die von Drüsensekretionen des Endometriums besetzt sind, die dann durch mütterliches Blut ersetzt werden, indem sie Kapillargefäße und Endometriumvenen schwächen.
Diese intrazellulären Lagunen, die mit mütterlichem Blut gefüllt sind.
Zwischenräume im Syncitiotrophoblasten werden Trabeculae bezeichnet. Die Embryogenese, die aus Veränderungen im Embryloblast des Innenraums der Blastozyste besteht.
Uterus-plazentäre Kreislauf
Eine der grundlegenden Funktionen des Syncitiotrophoblasten ist der Stoffwechselaustausch zwischen Mutter und Fötus, der eine hohe endokrine Aktivität zeigt und an der Homöostase der embryonalen Entwicklung teilnimmt.
Das Erscheinen von intrazellulären oder trophoblastischen Lagunen in der Syncytiotrophoblasten beginnt die Entwicklung der Gebärmutter-plazentären Kreislauf. In diesen Lagunen stammen die Sinusoide aus den Kapillaren des mütterlichen Teils des Plazenta -Flusses.
Ein Richtstrom wird durch den Differentialdruck zwischen den Kreislaufgefäßen und den trophoblastischen Lagunen gebildet. Dieser Fluss reicht von den Arterien bis zu den Venen und bildet den primitiven Uterus-Plazenta-Kreislauf.
Es gibt eine Nährstoffübertragung von den mütterlichen Gefäßen in den Embryo, was bei der Beobachtung der reichlich vorhandenen Pinozyten -Vesikel der Syncitiotrophoblast deutlich wird.
Die syncitiale Zellschicht bedeckt die schwimmenden Zotten der Plazenta. Diese Zotten kommen mit mütterlichem Blut in Kontakt, wenn die Gebärmutter-Plazenta-Kreislauf hergestellt wird, wodurch der Sauerstoff- und Nährstofftransport reguliert wird.
Kann Ihnen dienen: Was sind Spermatogonien und welche Art sind da??Plazenta -Apoptose
Die Apoptose oder der programmierte Tod von Zellen erweisen sich als wichtige Komponente bei der embryonalen Entwicklung, wodurch die Eliminierung ausgewählter Zellen auftritt, um einen wahllosen Verlust von Zellen zu verhindern. Die syncitiale Fusion von Cytotrophoblastenzellen ist die Anfangsphase des apoptotischen Wasserfalls.
Im Anfangsstadium der Apoptose Cytotrophoblastenzelle.
In der Apoptoseausführungsphase ist das zytoplasmatische und nuklisch -Material des Cytotrophoblasten an die syncitielle Schicht übergeben, sodass die Zellen der letzteren Schicht mit dem erforderlichen Material für den apoptotischen Wasserfall ausgestattet sind, um zu beginnen.
Der apapaptotische Prozess hat eine vorübergehende Pause aufgrund der Wirkung antiapopptotischer Enzyme. Andere Enzyme, die für die Abbau von Zellmikrofilamenten zuständig sind.
Nach dem Abbau der zellulären Komponenten wird der Abfall in apikalen Membranen der Syncitotophoblast verpackt, was die synkitiellen oder apoptotischen Knoten verursacht, die schließlich im Blutkreislauf der Mutter freigesetzt werden.
Apoptose und Präeklampsie
Präeklampsie ist eine Pathologie, die während der Schwangerschaft vorgestellt wird. Einige Untersuchungen haben gezeigt, dass diese Pathologie durch eine Veränderung der Differenzierung von Trophoblasten aufgrund eines Überschusses an apoptotischen Prozessen auf dieser Ebene verursacht wird.
Die Freisetzung von apoptotischen Abfällen im Blutkreislauf mütterlicherseits verursacht keine Entzündungsreaktionen bei der Mutter, da diese Abfälle durch eine Membran geschützt sind, die sie daran hindert, mit mütterlichen Strukturen in Kontakt zu treten. Der Abfallbeschichtungsprozess dauert einige Wochen.
Bei Präeklampsie gibt es einen Überschuss an Proliferation und Fusion von Cytotrophoblastikzellen, was zu einem Anstieg des Zellabbaus in der Syncytiotrophoblasten führt. Dieser Anstieg führt zu einer Anreicherung von Zellabfällen und zu einer Verzögerung der Bildung ihrer Schutzmembran.
Kann Ihnen dienen: Rezeptor -vermittelte Endozytose: Prozess und FunktionenDies führt zu teilweise degradierten Abfällen und Mikrophragmenten, einschließlich der Syncitiotrophoblasten -Enzyme, um zum Blutkreislauf der Mutter zu gehen, der Gewebeschäden verursacht. Zusätzlich zur Präeklampsie waren Hypoxiezustände in der Plazenta mit einer Zunahme der Zellapoptose zusammenhängen.
Beweis für die Beziehung zwischen Apoptose und Präeklampsie
Bei Patienten mit Präeklampsie wurde festgestellt. Diese Mikrophragmente können das Verhalten von Makrophagen verändern und gleichzeitig zu einer Zunahme der Aktivierung von Neutrophilen und einer verringerten Endothelrelaxation führen.
Diese Veränderungen in Blutzellen der Mutter erklären systemische Schäden und Manifestation von Präeklampsie, was zu Epithelschäden und einer entzündlichen Reaktion führt. Zusätzlich zur Schädigung der Plazenta aufgrund einer Zunahme der Fibrinoidablagerungen auf den Zotten.
Verweise
- Blumen, a. M., Montoya, J. B., Aguilar, a. ENTWEDER., & Ortega, f. V. (2006). Entwicklung und Validierung eines In -vitro -Kulturmodells für die Untersuchung der Unterschiede von menschlichem Trophoblasten. Gynäkologie und Geburtshilfe von Mexiko, 74 (12), 657-665.
- Hernández-Valencial, m., Valencia-ortega, J., Ríos-Castillo, geb., Cruz-Cruz, p. D. R., & Vélez-sánchez, D. (2014). Implantationselemente und Plazentation: klinische und melekulare Aspekte. Mexikanische Fortpflanzungsmedizinmagazin, 6 (2), 102-16.
- Reece, e. ZU., & Hobbins, j. C. (2010). Geburtshelfer klinische/klinische Geburtshilfe. Ed. Pan -American Medical.
- Rodríguez, m., Couve, c., Egaña, g., & Chamy, v. (2011). Plazenta -Apoptose: Molekulare Mechanismen in der Entstehung von prälampsie. Chilenische Geburtshilfe- und Gynäkologiemagazin, 76 (6), 431-438.
- Ross, m. H., & Pawina, w. (2007). Histologie. Ed. Pan -American Medical.
- Roura, l. C. (2007). Geburtshilfe und mütterliche Fetalmedizin. Ed. Pan -American Medical.

