Kristalline Festkörperstruktur, Eigenschaften, Typen, Beispiele

- 2403
- 606
- Timo Rabenstein
Der kristalline Festkörper Sie sind diejenigen, deren mikroskopische Strukturen geordnet sind, und gehorchen einem charakteristischen Muster für ein bestimmtes kristallines Netzwerk. Zum Beispiel: kubisch, hexagonal, triklinisch, rhomboédrica unter anderem.
Es wird gesagt, dass diese Feststoffe als Kristalle existieren, die Facetten und geometrische Designs zeigen, die widerspiegeln, wie geordnet ist. Andere Beispiele für kristalline Feststoff sind Diamant, Quarz, Anthracen, Trockeneis, Kaliumchlorid oder Magnesiumoxid.
 Eine kriminelle Kristallbar. Quelle: Pixabay.
Eine kriminelle Kristallbar. Quelle: Pixabay. Ein Paar hoch bekannter kristalliner Feststoffe ist die von Zucker und Salz (NaCl). Auf den ersten Blick tragen beide weiße Kristalle; Aber seine Eigenschaften unterscheiden sich stark. Zucker ist ein molekulares kristallines Feststoff, während Salz ein ionischer Kristallin festgelegt ist. Der erste besteht aus Saccharosemolekülen; Und die zweite von na ionen+ und Cl-.
Das obere Bild ermöglicht es Ihnen, zu werfen, wie helle Zuckerkristalle sein können. Salzkristalle sind jedoch nicht weit dahinter zurück. Obwohl Zucker und Salz wie Brüder aussehen, sind ihre Strukturen unterschiedlich: Zucker, der Saccharose wird, hat eine monoklinische Struktur; Während Salz eine Kubikstruktur.
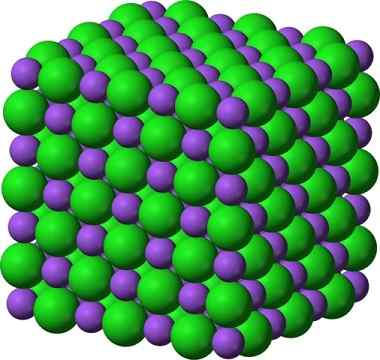 Kristallstruktur von Natriumchlorid, NaCl
Kristallstruktur von Natriumchlorid, NaCl Sprühte Zucker und Salz (Glas) bleiben kristallin; Seine Kristalle sind für unsere Augen nur viel kleiner geworden. Die Kristallinität eines Feststoffs wird daher eher durch seine innere Struktur als durch sein äußeres Aussehen oder seine Glitzer definiert.
[TOC]
Struktur kristalliner Feststoffe
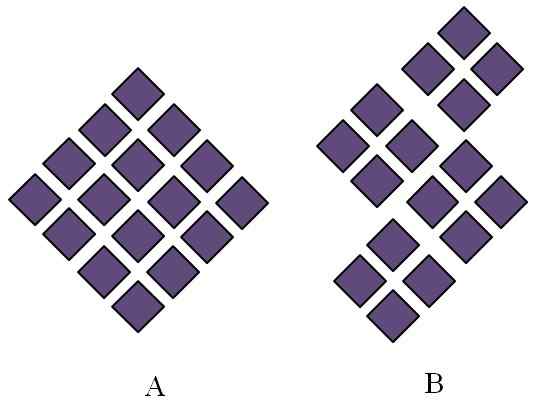 Geordnete Strukturen kristalliner Feststoffe. Quelle: Gabriel Bolívar.
Geordnete Strukturen kristalliner Feststoffe. Quelle: Gabriel Bolívar. Kristalline Feststoffe haben Strukturen geordnet. Die geometrischen Eigenschaften hängen von der Art des kristallinen Netzwerks ab, zu dem sie gehören, was wiederum extern in den Formen des Kristalls (Kristallsystem) projiziert wird. Das überlegene Bild zeigt zwei wichtige Konzepte solcher Strukturen: Periodizität und kristalline Körner.
Kann Ihnen dienen: VerbreitungsphaseDas räumliche System der Partikel eines kristallinen Feststoffs ist Zeitung; Das heißt, es wird immer wieder in alle Richtungen wiederholt. Dies verursacht ein eigenes strukturelles Muster für jedes feste und kristalline Netzwerk. Hier beginnen beispielsweise Salz und Zucker über seine chemische Natur hinaus zu unterscheiden.
In den Rhombuss wird ihnen angeordnet, zu einem Rhombus größerer Proportionen zu führen. Jeder lila Rhombus repräsentiert ein Teilchen oder eine Menge von ihnen (Atome, Ionen oder Moleküle). Es ist daher zu erwarten.
In B werden in B die Rhombuss so geordnet, dass sie kristalline Körner stammen; Dies sind sehr kleine Kristalle (Kristallite). Es wird dann gesagt, dass B ein polyristaler Feststoff ist; Das heißt, es wird durch das Agglomeration mehrere Kristallite gebildet.
Zusammenfassend kann ein Feststoff einfach kristallin (a) oder polyristalin (b) sein; In Form von Kristallen, während B polyristales.
Eigenschaften
Die Eigenschaften kristalliner Feststoffe hängen von seiner Glasart ab. Es ist bekannt, dass ihre Strukturen angeordnet werden und dass sie normalerweise auch brillante Fraktionen aufweisen, die sich in Mineralliebhaber verlieben. Es wurde jedoch erwähnt, dass ein fester Staub, einschließlich "Aus", auch als kristallin eingestuft werden kann.
Die Art und Weise, wie ihre Partikel räumlich ausgerichtet sind, ermöglicht es ihnen, einige wichtige Eigenschaften für ihre Charakterisierung zu haben. Beispielsweise können kristalline Feststoffe X -Strahlen abbauen und Beugungsspektren erzeugen, aus denen die mikroskopische Struktur eines Kristalls bestimmt werden kann.
Da die Struktur regelmäßig ist, wird die Wärme auf die gleiche Weise über den Feststoff verbreitet. Solange dazwischen keine Verunreinigungen sind. Somit sind die Schmelzpunkte für einen kristallinen Feststoff konstant und variieren nicht, unabhängig davon, wie sie gemessen werden.
Es kann Ihnen dienen: Gallium: Eigenschaften, Struktur, erhalten, verwendet, verwendetArten von kristallinen Feststoffen
Die Arten von kristallinen Feststoffen basieren auf der Art von Partikeln und welche Wechselwirkungen oder Verbindungen sind sie. Es gibt vier Typen: ionische, metallische, molekulare und kovalente Netzwerke.
Selbst wenn sie ein gewisses Maß an Verunreinigungen aufweisen, sind sie weiterhin kristallin, obwohl ihre Eigenschaften betroffen sind und nicht die gleichen erwarteten Werte für einen reinen Feststoff zeigen.
Ionisch
Salz ist ein Beispiel für einen ionischen kristallinen Feststoff, da es aus NA -Ionen besteht+ und Cl-. Daher regiert die ionische Bindung bei dieser Art von Feststoffen: Es sind die elektrostatischen Kräfte, die die strukturelle Ordnung regeln.
Metall
Alle Metallatome bilden metallische Kristalle. Dies bedeutet, dass beispielsweise eine Silbergabel ein Konglomerat von verschmolzenen Silberkristallen ist. Die interne oder mikroskopische Struktur ist in jeder Handfläche des Objekts gleich und bleibt vom Griff der Gabel bis zur Spitze seiner Zähne unverändert.
Molekular
Zucker ist ein Beispiel für einen molekularen kristallinen Feststoff, da er aus Saccharosemolekülen besteht. Daher besteht diese Art von Feststoff aus Molekülen, die durch seine intermolekularen Wechselwirkungen (und nichtkovalente Bindungen) es schaffen, eine geordnete Struktur festzulegen.
Kovalente Netzwerke
Schließlich haben wir die kristallinen Feststoffe kovalenter Netzwerke. Sie überwiegen kovalente Bindungen. Es gibt keine Rede von Ionen, Atomen oder Molekülen, sondern von dreidimensionalen Netzwerken.
Beispiele
Als nächstes und schließlich werden einige Beispiele für jede der Arten von kristallinen Feststoffen zitiert.
Kann Ihnen dienen: ElektronegativitätIonisch
Alle Salze sind ionische Feststoffe. Es gibt auch Sulfide, Hydroxide, Oxide, Halogenide und andere Verbindungen, die ebenfalls von Ionen gebildet werden, oder ihre Wechselwirkungen sind in ionischen Essenz. Wir haben:
-Kcl
-Fall4
-Ba (oh)2
-Cuso4
-Fecl3
-N / A2S
-Mgo
-CAF2
-Nahco3
-(NH4)2Cro4
Zusätzlich zu diesen Beispielen gelten die überwiegende Mehrheit der Mineralien als ionische kristalline Festkörper.
Metall
Jedes metallische Element wird natürlich als Metallkristalle dargestellt. Einige von ihnen sind:
-Kupfer
-Eisen
-Aluminium
-Chrom
-Metallischer Wasserstoff (unter unvorstellbaren Druck)
-Wolfram
-Zirkonium
-Titan
-Magnesium
-Natrium
Molekular
Es gibt eine Vielzahl von molekularen kristallinen Feststoffen. Praktisch jede organische Verbindung, die sich festsieht, schafft es, Kristalle zu etablieren, wenn ihre Reinheit hoch ist oder wenn seine Struktur nicht zu kompliziert ist. Also haben wir:
-Eis (h2ENTWEDER)
-Trockeneis (co2)
-Yo2
-P4
-S8 (und seine Polymorphen)
-Anthracen
-Fester Sauerstoff
-Solide Ammoniak
-Phenolphthalein
-Benzoesäure
Kovalente Netzwerke
Und schließlich unter einigen kristallinen Feststoffen kovalenter Netzwerke haben wir:
-Diamant
-Graphit
-Kohlenstoff-Nanoröhren
-Fullerenos
-Quarz
-Silizium
-Germanium
-Bor Nitrid
Aus dieser Liste könnten Kohlenstoffnanoröhren und Fulleren auch als molekulare kristalline Festkörper angesehen werden. Dies liegt daran, dass sie, obwohl sie aus kovalent vereinigten Kohlenstoffen bestehen, Einheiten definieren, die als Makromoleküle (Fußballkugeln und Röhren) sichtbar gemacht werden können.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2020). Kristall. Abgerufen von: in.Wikipedia.Org
- Chemistry Librettexts. (16. Juni 2019). Kristalline und amorphe Feststoffe. Erholt von: Chem.Librettexts.Org
- Rachel Bernstein & Anthony Carpi. (2020). Eigenschaften von Feststoffen. Erholt von: VisionLearning.com
- « Amorphe Festkörperstruktur, Eigenschaften, Beispiele
- Demografische Explosionsursachen, Konsequenzen, Vorteile, Nachteile »

