Hypertonische Lösung
- 4136
- 1013
- Frederike Birkemeyer
Wir erklären, welche hypertonischen Lösungen sind, wie die Merkmale sind, welche Unterschiede mit den Hypotonikern verwendet werden, und geben mehrere Beispiele an
Viele werden überrascht sein zu wissen, dass die Art und Weise, wie Pflanzen Wasser durch ihre Wurzeln absorbieren.
Beide Dinge passieren dank der Existenz einer Membran, die als Filter fungiert, und einer hypertonischen Lösung, die buchstäblich Wasser dadurch saugt. Aber was ist eine hypertonische Lösung?
In diesem Artikel wird diese Frage beantwortet, und die relevantesten Merkmale hypertonischer Lösungen werden ebenfalls vorgestellt, wofür sie sind, wie sie sich von anderen Arten von Lösungen und einigen Beispielen davon unterscheiden.
Was ist eine hypertonische Lösung?
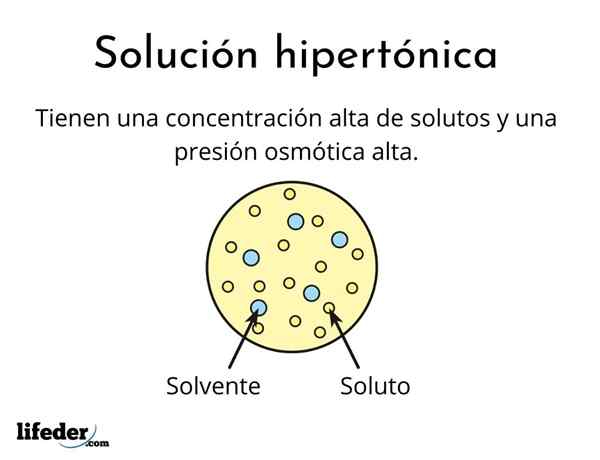
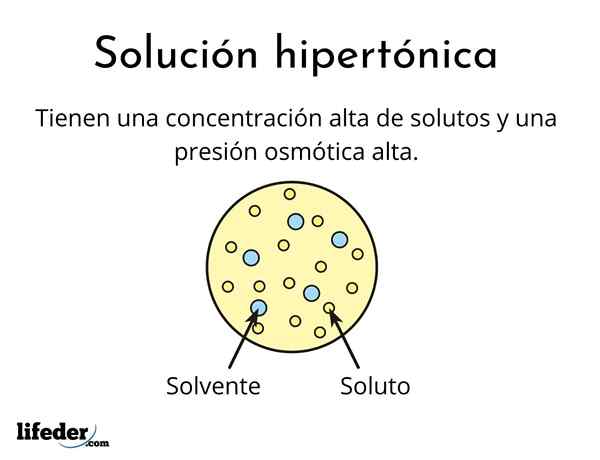
A hypertonische Lösung Es ist eines, das eine Gesamtkonzentration von osmolarisch aktiven gelösten gelösten Stoffe enthält als die einer anderen Referenzlösung. Osmolinär aktives bedeutet, dass gelöste Stoffe keine spezielle Membrantyp (ähnlich wie ein Gewebe) überqueren können, die als Sieb oder Filter, dh das Wasser passieren, und nicht als die gelösten Partikel.
Diese hohe Konzentration von gelösten Stoffen bewirkt, dass hypertonische Lösungen einen hohen osmotischen Druck aufweisen. Dieser Druck saugt das Wasser praktisch durch die Membran, die als Osmose bezeichnet wird.
Das hypertonische Wort stammt aus dem griechischen Präfix-Hyper-, was "auf oder über" und "Töne" bedeutet, was Spannung oder Druck bedeutet, so dass hypertonisch wörtlich "dass es mehr Druck oder Spannung hat".
Es ist wichtig zu bedenken.
Eigenschaften hypertonischer Lösungen
Hypertonische Lösungen haben einige grundlegende Eigenschaften:
Sie werden durch ein Lösungsmittel und mindestens einen gelösten Stoff gebildet
Keine Lösung kann hypertonisch sein, obwohl sie sehr konzentriert ist. Der gelöste gelöste muss nicht in der Lage sein, die Membran zu überqueren, während das Wasser es ohne Probleme bestehen kann, sonst wird der osmotische Druck nicht erzeugt.
Sie haben hohe Konzentrationen an gelösten Stoff
Dies macht sie hypertonische Lösungen. Wie vor einem Moment erwähnt, sind hypertonische Lösungen konzentrierter als Blut.
Es kann Ihnen dienen: fraktionelle Destillation: Prozess, Geräte, Anwendungen, BeispieleSie können unterschiedliche Kompositionen haben
Eine hypertonische Lösung kann einen einzelnen gelösten Salz oder eine Mischung aus gelösten Stoffen wie Salzen und Zucker enthalten.
Solutos können ionisch, neutral oder beides sein
Verkäufe enthalten Ionen mit elektrischen Gebühren, die sie nicht über die Membran überqueren lassen, sodass sie klein sind. Andere gelöste Stoffe haben keine Ionen, aber sie sind groß und fett und passen nicht durch die Löcher.
Sie haben einen hohen osmotischen Druck
Wie oben erwähnt, haben hypertonische Lösungen einen osmotischen Druck, der größer ist als Blut.
Sie können Zellen dehydrieren
Hypertonische Lösungen extrahieren das Wasser aus den Zellen und lassen sie als Rosinen zurück. Deshalb werden unsere Hände und Füße faltig, wenn wir am Strand baden.
Was sind hypertonische Lösungen für?
Hypertonische Lösungen haben im täglichen Leben und auch in der Medizin viele Verwendungszwecke. Einige der häufigsten Verwendungen sind:
Sie werden verwendet, um Essen zu behalten
- Beispiel: Die Pfirsiche im Sirup verrotten sich nicht, weil der Sirup viel gelöster Zucker hat und eine sehr hypertonische Lösung ist. Durch dehydrierende Zellen erlauben hypertonische Lösungen keine Pilze und Bakterien in Lebensmitteln, weil sie an Durst sterben. Dadurch können Lebensmittel mehr halten.
Sie dienen dazu, Entzündungen zu reduzieren
- Beispiel: Wenn jemand einen Unfall hat und den Kopf trifft, gibt es viele Male eine Entzündung im Gehirn. Um den Patienten zu heilen, injizieren Ärzte eine Salzlösung von 7,5% iger Salzlösung. Diese Lösung saugt praktisch Wasser und reduziert die Entzündung im Gehirn.
Sie dienen dazu, Elektrolyte zu ersetzen.
- Beispiel: Natrium ist ein Elektrolyt, den wir leben müssen, und wenn ein Patient wenig Natrium im Blut hat, wird eine Kochsalzlösung von 7,5% injiziert, um das verlorene Natrium wieder aufzufüllen.
Sie werden für parenterale Lebensmittel verwendet
- Beispiel: Wenn Menschen nicht durch den Mund oder eine Röhre essen können, ernähren sie sich in einer hypertonischen Lösung, die eine Art Zucker enthält, die als Glukose bezeichnet werden.
Unterschiede mit hypotonischen und isotonischen Lösungen
So wie es hypertonische Lösungen gibt, gibt es auch hypotonische und isotonische Lösungen. Der Unterschied zwischen letzteren und hypertonischen Lösungen ist seine Konzentration. Hypotonische Lösungen sind diejenigen, die weniger konzentriert sind als Blut, und isotonisch haben die gleiche Konzentration wie Blut.
Zum Beispiel ist reines Wasser, wie es nichts gelöst hat, hypoton, während Kokoswasser Salze und Zucker mit einer Konzentration aufweist.
Zusätzlich zur Unterscheidung durch ihre Konzentration unterscheiden sich Hyper-, Hypo- und isotonische Lösungen in der Art und Weise, wie sie die Zellen beeinflussen.
Das folgende Bild zeigt die Wirkung der verschiedenen Arten von Lösungen auf rote Blutkörperchen (der kleinen Zellen, die das Blut rot machen).
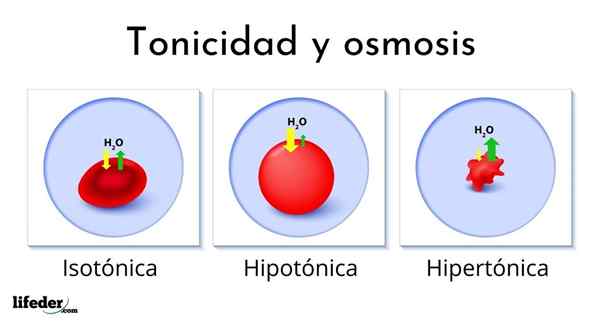
Wenn rote Blutkörperchen in eine hypertonische Lösung eingeführt werden, extrahiert sie das Wasser, dehydriert sie und lässt sie als Pass gefalten.
Andererseits absorbieren rote Blutkörperchen Wasser und schwellen, wenn sie in eine hypotonische Lösung eingeführt werden, sogar wie ein Ballon platzen, der zu viel aufblitzt. Wenn sie schließlich in eine isotonische Lösung eingeführt werden.
Beispiele für hypertonische Lösungen
Zuckersirup
 Pfirsiche im Sirup
Pfirsiche im Sirup Der Sirup, in dem Pfirsiche und andere Früchte erhalten bleiben.
Die Salzlösung
Die Sole ist eine Lösung von Wasser und Salz mit sehr hohen Konzentrationen zwischen 3,5% und 25%, was fast 30 -mal konzentrierter werden kann als Blut (dh es ist sehr hypertonisch).
Der Essig
Ein häufiger Essig ist eine hypertonische Lösung, da er eine Konzentration zwischen 3% und 5% Essigsäure aufweist. Balsamico -Essigreduzierungen sind noch konzentrierter.
Kann Ihnen dienen: Dimethylamin ((CH3) 2NH): Struktur, Eigenschaften, Verwendungen, RisikenDas gleiche Blut unserer Adern, nachdem er viel geschwitzt hatte.
Beim Training und Schwitzen eliminiert der Körper Wasser und Salze, eliminiert jedoch mehr Wasser als Salze (Schweiß ist hypotonisch), damit sich das Blut konzentriert und hypertonisch wird.
Meerwasser
Das Meerwasser enthält viele gelöste Salze mit einer Gesamtkonzentration von etwa 3,5%, was es hypertonisch macht. Deshalb falten Meerwasser die Finger.
Zuckerhaltige Getränke
Cola -Getränke und andere zuckerhaltige Getränke können bis zu 10% Zucker sowie Salze und andere gelöste Stoffe mit Konzentrationen größer als Blut enthalten.
5% Dextrose -Lösung und 0,45% Natriumchlorid (D5 ½ ns)
Dies ist ein Beispiel für eine hypertonische Lösung, die verwendet wird, um Menschen zu füttern, die normalerweise nicht am Mund essen können.
25% Mannitol
Dies ist eine Lösung, die häufig zur Behandlung von Stoßdämpfer am Kopf verwendet wird. Es ist viermal konzentrierter als Blut.
7,5% Kochsalzlösung
Es ist eine ziemlich konzentrierte Salzlösung, die auch einige Patienten mit bestimmten Krankheiten in den Venen injiziert wird.
Handelssäfte
Alle Säfte, die im Supermarkt gekauft und nicht natürlich sind, haben sehr hohe Zuckerkonzentrationen, die sie hypertonisch machen.
Verweise
- Sweeney J. Verwaltung von Hypernatriämie. Pflege. September 2010; 40 (9): 63.
- Sole. Wikipedia. 2021. Genommen von.Wikipedia.org/wiki/sole.
- Meerwasser. Wikipedia. 2021. Genommen von.Wikipedia.Org/wiki/Meerwasser.
- Chavaltamrong B, Pidatcha P, Thavisri U. Elektrolyte, Zucker, Kalorien, Osmolarität und pH -Wert von Getränken und Kokosnusswasser. Südostasiatische J Trop Med Public Health. September 1982; 13 (3): 427-431.
- 5% Dextrose und 0.45% Natriumchloridinjektion, USP. FDA. 2006. Von AccessData entnommen.FDA.GOV/DECRYSATFDA_DOCS/LABE/2006/017607S123LBL.PDF.
- Llorente G, Niño MC. Manitol gegen hypertonische Kochsalzlösung in der Neuroanästhesie. Kolumbianische Anästhesiologiemagazin. Januar März 2015; 43 (1): 29-39.
- Heilige MM, e. Behandlung von akuter Pansen -Laktatazise mit intravenösem hypertonischem Natriumchlorid oder Bicarbonat -Lösungen, die von intrauminales Wasser gefickt werden. Forschung in Veterinärwissenschaft. Februar 2020; 128: 24-34.
- Dini-g. E, Abreu-C. JD, López-M. UND. Osmolalität häufiger Konsumgetränke. Klinische Forschung. Dezember 2004; 45 (4).

