Hypotonische Lösungskomponenten, Vorbereitung, Beispiele
- 4953
- 506
- Timo Rabenstein
A Hypotonische Lösung Es ist eines, das eine Konzentration von geringfügigen gelösten gelösten Lösung in Bezug auf eine durch einen semipermaable Fehler getrennte oder isolierte Lösung darstellt. Diese Barriere ermöglicht das Lösungsmittel Transte, Wasser bei biologischen Systemen, aber nicht alle gelösten Partikel gelöst.
Körperflüssigkeiten von intrazellulären und extrazellulären Wirbeltieren haben eine Osmolarität von etwa 300 mosm/l. Es wird jedoch angenommen, dass eine hypotonische Flüssigkeit eine Osmolarität von weniger als 280 mosm/l hat. Eine Lösung dieser Osmolarität ist also hypoton in Bezug auf das zelluläre Medium.
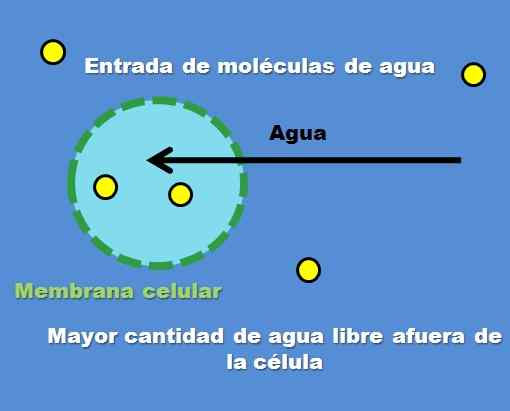
 Interaktion einer Zelle mit einer hypotonischen Lösung. Quelle: Gabriel Bolívar.
Interaktion einer Zelle mit einer hypotonischen Lösung. Quelle: Gabriel Bolívar. Ein Beispiel für eine hypotonische Lösung ist 0,45% Natriumchlorid. Aber wie verhalten sich die Zelle oder das Kompartiment vor dieser Art von Lösung?? Das überlegene Bild beantwortet diese Frage.
Die Konzentration von Partikeln gelösten (gelbe Punkte) ist innerhalb der Außenzelle höher. Wenn Sie weniger gelöst in der Zelle haben, gibt es mehr freie Wassermoleküle, so dass sie im Vergleich zum Inneren der Zelle mit einer intensiveren blauen Farbe dargestellt wird.
Das Wasser fließt durch Osmose nach außen, um Konzentrationen zu beteiligen. Infolgedessen dehnt sich die Zelle aus oder fächer, indem er Wasser absorbiert, das ihre Zellmembran überschreitet.
[TOC]
Komponenten hypotonischer Lösungen
Hypotonische Lösungen bestehen aus einem Lösungsmittel, das, sofern nicht anders angegeben, aus Wasser und in IT gelöste gelöste gelösten gelösten Stoffe wie Salze, Zucker usw., in reiner oder gemischter Form. Diese Lösung hat jedoch keine Tonizität, wenn es keine semipermeable Barriere gibt, die zur Zellmembran wird.
Es kann Ihnen dienen: Calciumnitrat (CA (NO3) 2)Es müssen nur wenige gelöste Salze sein, so dass seine Konzentration klein ist, während die "Konzentration" des Wassers hoch ist. Mehr freies Wasser außerhalb der Zelle, dh es löst oder feuchtigkeitsspendende Partikel, desto größer wird sein Druck auf die Zellmembran und mehr dazu neigt, sie zu überqueren, um die intrazelluläre Flüssigkeit zu verdünnen.
Herstellung einer hypotonischen Lösung
Für die Vorbereitung dieser Lösungen wird das gleiche Protokoll befolgt, das für andere Lösungen befolgt wird. Die geeigneten Berechnungen der Masse der gelösten Stoffe werden durchgeführt. Dann werden diese gewogen, löst sich in Wasser auf und nehmen eine Flagge, die dem Volumen geteilt wird, das ihm entspricht.
Die hypotonische Lösung hat eine niedrige Osmolarität, normalerweise weniger als 280 mosm/l. Bei der Vorbereitung einer hypotonischen Lösung müssen wir Ihre Osmolarität so berechnen, dass ihr Wert weniger als 280 mosm/l beträgt. Die Osmolarität kann mit der folgenden Gleichung berechnet werden:
Osmolarität = m · v · g
Wo M Es ist die Molarität des gelösten Stoffes und v Die Anzahl der Partikel, bei denen eine Verbindung in Lösung dissoziiert wird. Nicht -elektrolytische Substanzen dissoziieren sich nicht, so dass der Wert von V gleich 1 ist. Dies ist der Fall von Glukose und anderen Zucker.
Während G ist der osmotische Koeffizient. Dies ist ein Korrekturfaktor für die Wechselwirkung elektrisch geladener Partikel (Ionen) in Lösung. Für verdünnte Lösungen und nicht -dissozierende Substanzen, zum Beispiel Glukose, wird ein Wert von G gleich 1 genommen. Es wird dann gesagt, dass Molarität mit ihrer Osmolarität identisch ist.
Beispiel 1
Bereiten Sie eine Natriumchloridlösung (NaCl) bei 0,5 % (P/V) vor und prüfen Sie, ob es sich um eine hypotonische Lösung handelt oder nicht. NaCl -Molekulargewicht = 58,5 g/mol.
Die 0,5 % einer Gramm -NaCl -Lösung pro Liter wird getragen:
Kann Ihnen dienen: Calciumperoxid (CAO2): Eigenschaften, Risiken und VerwendungNaCl in g/l = 0,5 g ÷ 100 ml) · 1.000 ml
= 5 g/l
Und wir berechnen ihre Molarität und bestimmen dann seine Osmolarität:
Molarität = Masse (g/l) ÷ Molekulargewicht (g/mol)
= 5 g/l ÷ 58,5 g/mol
= 0,085 Mol/l
NaCl dissoziiert in zwei Partikeln: na+ (Kation) und Cl- (Anion). Also der Wert von v = 2. Da es sich um eine verdünnte 0,5 %ige NaCl -Lösung handelt, kann davon ausgegangen werden, dass der Wert von G (osmotischer Koeffizient) 1 beträgt. Wir haben dann:
Osmolarität (NaCl) = Molarität · V · g
= 0,085 m · 2 · 1
= 0,170 osm/l o 170 mosm/l
Dies handelt.
Beispiel 2
Bereiten Sie eine Lösung einer Mischung aus Calciumchlorid (CACL "vor2) bei 0,055 % (P/V) und Glucose (C)6H12ENTWEDER6) bei 4 % (P/V). Molekulargewichte: CaCl2 = 111 g/mol und c6H12ENTWEDER6 = 180 g/mol.
Wir berechnen die Molarität mit den Konzentrationen der jeweiligen gelösten Stoffe bei 0,55 g/l und 40 g/l:
Molarität (CaCl2) = 0,55 g/l ÷ 111 g/mol
= 4,95 · 10-3 M
= 4,95 mm
Molarität (c6H12ENTWEDER6) = 40 g/l ÷ 180 g/mol
= 0,222 m
= 222 mm
Und auf die gleiche Weise berechnen wir die Osmolaritäten, da wir wissen, dass der Klick2 Es dissoziiert drei Ionen, zwei CL- Und a ca2+, und vorausgesetzt, sie sind sehr verwässerte Lösungen, also der Wert von v Es ist 1. Wir haben:
Osmolarität (CaCl2) = 4,95 mm · 3 · 1
= 14,85 mosm/l
Osmolarität von (C)6H12ENTWEDER6) = 222 mm · 1 · 1
= 222 mosm/l
Schließlich wird die Gesamtosmolarität der Lösung zur Summe einzelner Osmolaritäten; Das heißt, aus denen von NaCl und Glukose. Dies ist daher:
Kann Ihnen dienen: FeuerfestmaterialienGesamtopolanz der Lösung = CaCl -Osmolarität2 + Osmolarität c6H12ENTWEDER6
= 222 mosm/l + 14,85 mosm/l
= 236,85 mosm/l
Die Lösung der Mischung aus Kalzium und Glucosechlorid ist hypotonisch, da seine Osmolarität (236,85 mosm/l) viel geringer ist als die Plasma -Osmolarität (300 MOSM/l), die als Referenz genommen wird.
Beispiele für hypotonische Lösungen
Natriumchloridlösung
0,45 % Natriumchloridlösung werden intravenös an Patienten mit diabetischer Ketose verabreicht, die Dehydration in interstitiellen und intrazellulären Kompartimenten entwickeln. Wasser fließt von Plasma zu diesen Fächern.
Ringer Laktatlösung
Ringer Laktatlösung Nr. 19 ist ein weiteres Beispiel für eine hypotonische Lösung. Seine Zusammensetzung beträgt 0,6 g Natriumchlorid, 0,03 g Kaliumchlorid, 0,02 g Calciumchlorid, 0,31 g Natriumlactat und 100 ml destilliertes Wasser. Es handelt sich um eine Lösung, die für die Rehydration von Patienten verwendet wird und leicht hypotonisch ist (274 MOSM/L).
Verweise
- Von lehr spilva bis. Und Muktans und. (1999). Leitfaden für pharmazeutische Spezialitäten in Venezuela. XXXVª Edition. Globale Ausgaben.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Wikipedia. (2020). Tonizität. Abgerufen von: in.Wikipedia.Org
- Union Media LLC. (2020). Isotonische, hypotonische und hypertonische Lösungen. Abgerufen von: UnionTestPrep.com
- Lodisch H, Berk A, Zipursky SL, et al. (2000). Abschnitt 15.8osmose, Wasserkanäle und die Regulierung des Zellvolumens. NCBI -Bücherregal. Erholt von: NCBI.NLM.NIH.Regierung
- John Brennan. (13. März 2018). Wie man die Isotonizität berechnet. Erholt von: Scienting.com

