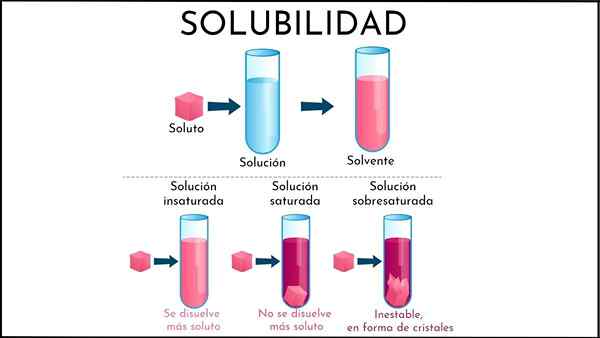
Ungesättigte Lösung
- 2619
- 11
- Ibrahim Steuk
 In der ungesättigten Lösung kann die Lösungsmittelhälfte immer noch mehr gelöste gelöst werden
In der ungesättigten Lösung kann die Lösungsmittelhälfte immer noch mehr gelöste gelöst werden Was ist eine ungesättigte Lösung?
A ungesättigte Lösung Es ist alles diese Lösung, in der das Lösungsmittelmedium immer noch mehr gelöste gelöst wird. Dieses Medium ist im Allgemeinen flüssig, obwohl es auch gasförmig sein kann. In Bezug auf den gelösten Stoff ist es ein Konglomerat aus festen oder gasförmigen Partikeln.
Und was ist mit flüssigen gelösten Stoffe?? In diesem Fall ist die Lösung homogen, solange beide Flüssigkeiten mischbar sind. Ein Beispiel hierfür ist die Zugabe von Ethylalkohol am Wasser; Die beiden Flüssigkeiten mit ihren Molekülen, Cho3CH2Oh und h2Oder sie sind mischbar, weil sie Wasserstoffbrücken bilden (wählen Sie3CH2Oh oh2).
Wenn sich Diclormethan jedoch mischt (wählen Sie2Cl2) und Wasser würden eine Lösung mit zwei Phasen bilden: eine wässrige und die andere organisch. Dies liegt daran, dass Choles von CH2Cl2 und h2Oder sehr schwach interagieren, also gleiten einige über die anderen, was zu zwei nicht mischbaren Flüssigkeiten führt.
Ein Mindestabfall von Cho2Cl2 (gelösten) genug, um das Wasser zu sättigen (Lösungsmittel). Wenn sie im Gegenteil eine ungesättigte Lösung bilden könnten, wäre eine vollständig homogene Lösung zu sehen.
Aus diesem Grund können nur feste und gasförmige gelöste Stoffe ungesättigte Lösungen erzeugen.
Was ist eine ungesättigte Lösung?
In einer ungesättigten Lösung interagieren Lösungsmittelmoleküle mit der Wirksamkeit, so dass gelöste Moleküle keine andere Phase bilden können.
Dies bedeutet, dass lösungsmittellösliche Wechselwirkungen angesichts der Druck- und Temperaturbedingungen, und stofflöslichen Wechselwirkungen überschreiten.
Sobald die von gelösten störenden Wechselwirkungen zunehmen, "orchestrieren" sie die Bildung einer zweiten Phase. Wenn das Lösungsmittelmedium beispielsweise eine Flüssigkeit ist und der gelöste Stoff ein Feststoff, löst sich der zweite in der ersten, um eine homogene Lösung zu bilden.
Es kann Ihnen dienen: PolymethylmetacrylatDieser Niederschlag ist auf die Tatsache zurückzuführen, dass die gelösten Moleküle gelöst werden, um durch ihre chemische Natur zu gruppieren, deren Struktur oder Verbindungen intrinsisch ist. In diesem Fall wird gesagt, dass die Lösung mit gelösten Stoff gesättigt ist.
Daher besteht eine ungesättigte Lösung gelöster gelöster Stoff aus einer flüssigen Phase ohne Niederschlag. Wenn der gelöste Stoff gasförmig ist, muss eine ungesättigte Lösung frei von Blasen vorhanden sein (die nichts anderes als Cluster von Erfrischungsgetränken sind).
Temperatureffekt
Die Temperatur beeinflusst direkt den Ungesättigungsgrad einer Lösung in Bezug auf einen gelösten Stoff.
Dies kann hauptsächlich aufgrund von zwei Gründen sein: die Schwächung von Wechselwirkungen mit gelösten Stoff-Solute aufgrund des Wärmeeffekts und der Zunahme von molekularen Schwingungen, die dazu beitragen, die gelösten Moleküle zu zerstreuen.
Wenn ein Lösungsmittelmedium als kompakter Raum betrachtet wird, in dessen Löcher die gelösten Moleküle untergebracht sind, erhöht die Temperatur die Moleküle, die die Größe dieser Löcher erhöhen. so, dass der gelöste Stoff in andere Richtungen gehen kann.
Unlösliche Feststoffe
Einige gelöste gelöste haben jedoch so starke Wechselwirkungen, dass Lösungsmittelmoleküle kaum in der Lage sind, sie zu trennen.
Wenn dies so ist, reicht eine minimale Konzentration des gelösten gelösten gelösten Stoff aus, damit sie ausfällt, und dann ist es ein unlöslicher Feststoff.
Unlösliche Feststoffe bilden durch Bildung einer zweiten festen Phase, die sich von der flüssigen Phase unterscheidet, nur wenige ungesättigte Lösungen.
Zum Beispiel, wenn 1L der Flüssigkeit A ohne Ausfällen nur 1 g B auflösen kann, dann beim Mischen von 1L A mit 0.5 g B erzeugen eine ungesättigte Lösung.
Es kann Ihnen dienen: HydrocoloidIn ähnlicher Weise bilden ein Rang der Konzentrationen zwischen 0 und 1 g B auch ungesättigte Lösungen. Aber nach 1 g wird B ausfällt. In diesem Fall wird die Lösung von ungesättigtem zu gesättigt von b.
Wenn eine gesättigte Lösung mit 1 dem Heizung eingereicht wird.5g B hilft die Auflösung des Niederschlags. Wenn es jedoch viel ausfällt ist, kann die Wärme sie nicht auflösen.
In diesem Fall würde ein Temperaturanstieg einfach das Lösungsmittel oder die Flüssigkeit zu verdampfen.
Beispiele für ungesättigte Lösung
Die Beispiele für ungesättigte Lösungen sind zahlreich, da sie vom Lösungsmittel und vom gelösten Stoff abhängen. Zum Beispiel für dieselbe Flüssigkeit A und andere gelöste Stoffe C, D, E… Z werden ihre Lösungen ungesättigt, solange sie keine Blase ausfällt oder bilden (wenn es sich um gasförmige gelöste Stoffe).
-Das Meer kann zwei Beispiele beitragen. Meerwasser ist eine massive Bergungslösung. Wenn Sie ein wenig von diesem Wasser kochen lassen, wird angemerkt, dass es in Abwesenheit von ausgefälltem Salz ungesättigt ist. Wenn das Wasser jedoch verdunstet, werden die aufgelösten Ionen gruppiert, so.
-Ein weiteres Beispiel ist die Auflösung von Sauerstoff im Meereswasser. Das Molekül von o2 Frank die Tiefen des Meeres genug, um die Meeresfauna zu atmen, obwohl es wenig löslich ist.
Aus diesem Grund ist es üblich, die Sauerstoffblasen zu beobachten, die an der Oberfläche auftauchen. von denen es ein paar Moleküle auflösen kann.
Eine ähnliche Situation tritt mit dem Kohlendioxidmolekül CO auf2. Im Gegensatz zu o2, Die co2 Es ist etwas löslicher, weil es mit Wasser reagiert, um Kohlensäure zu bilden, h2CO3.
Kann Ihnen dienen: MaterialsystemeUnterschied mit gesättigter Lösung
Zusammenfassung der neu erklärten, was sind die Unterschiede zwischen einer ungesättigten und gesättigten Lösung? Erstens der visuelle Aspekt: Eine ungesättigte Lösung besteht aus einer einzelnen Phase. Daher sollte es kein Vorhandensein von fester (fester Phase) oder Blasen (Soda -Phase) geben.
Außerdem können die Konzentrationen der gelösten Konzentrationen in einer ungesättigten Lösung variieren, bis ein Niederschlag oder eine Blase gebildet ist. Während in gesättigten, zweiphasigen Lösungen (flüssig-felid oder flüssig-gastlich) ist die Konzentration des gelösten gelösten gelösten gelösten Stoff konstant.
Weil? Weil die Partikel (Moleküle oder Ionen), die den Niederschlag ausmachen, ein Gleichgewicht mit denen herstellen, die im Lösungsmittel aufgelöst werden:
Partikel des Niederschlags gelösten Partikel
Blasenmoleküle gelöste Moleküle
Dieses Szenario wird nicht in ungesättigten Lösungen in Betracht gezogen. Beim Versuch, mehr gelösten gelösten gelösten Stoff in einer gesättigten Lösung, bewegt sich das Gleichgewicht nach links. zur Bildung von mehr Niederschlag oder Blasen.
Da in ungesättigten Lösungen dieses Gleichgewicht (Sättigung) noch nicht festgestellt wurde (Sättigung), kann fester oder gas "speichern".
Um ein Algen im Meeresboden gibt es gelösten Sauerstoff, aber wenn Sauerstoffblasen aus den Blättern geboren werden, bedeutet dies, dass GaSättigung auftritt. Andernfalls würden Blasen nicht beobachtet.
Verweise
- Allgemeine Chemie. Lehrmaterial. Lima: Päpstliche katholische Universität Peru. Erholt von: Korinth.PUCP.Edu.Sport
- Helmestine, Anne Marie, ph.D. (2018). Ungesättigte Lösungsdefinition. Erholt von: thoughtco.com
- Tutorvista (s.F.). Ungesättigte Lösung. Entnommen aus: Chemie.Tutorvista.com
- Chemistry Librettexts (s).F.). Arten der Sättigung. Erholt von: Chem.Librettexts.Org
- Nadine James. (2018). Ungesättigte Lösung: Definition & Beispiel. Erholt von: Studium.com

