Chemische Lösungen
- 4788
- 591
- Lewis Holzner
Wir erklären, welche chemischen Lösungen, ihre Merkmale, die bestehenden Typen und mehrere Beispiele geben
 Eine Chemikalie ist eine homogene Mischung zwischen zwei Substanzen
Eine Chemikalie ist eine homogene Mischung zwischen zwei Substanzen Was sind chemische Lösungen?
Der Chemische Lösungen Sie sind homogene Gemische zwischen einem Lösungsmittel und einem oder mehreren gelösten Stoffe. Die einfachsten Lösungen werden durch einen einzelnen gelösten Stoff und ein Lösungsmittel gebildet, z.
Die häufigsten Lösungen sind in einem flüssigen Zustand, und in den meisten Fällen ist das Lösungsmittel Wasser. Aus diesem Grund wird das Wasser normalerweise als "universelles Lösungsmittel" bezeichnet. Die Lösungen sind jedoch nicht auf Flüssigkeiten beschränkt, da es Lösungen in einem gasförmigen und festen Zustand gibt.
Der gelöste gelöste kann auch in verschiedenen Zuständen gefunden werden. Beispielsweise können flüssige Lösungen mit festen Stoffen (wie Salz), Flüssigkeiten (wie Alkohol) oder gasförmiger (z. B. Kohlenstoffgas in Erfrischungsgetränken) feste Lösungen haben).
Wie man den Stoff und das Lösungsmittel erkennt?
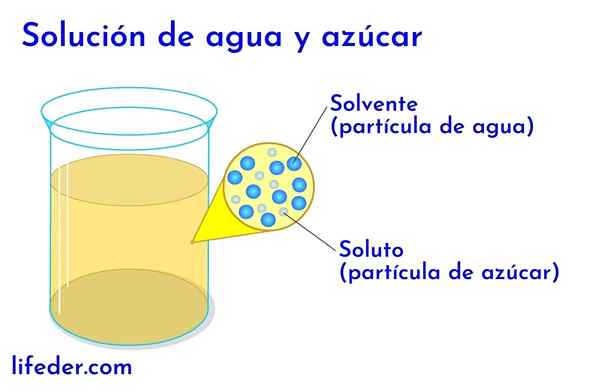
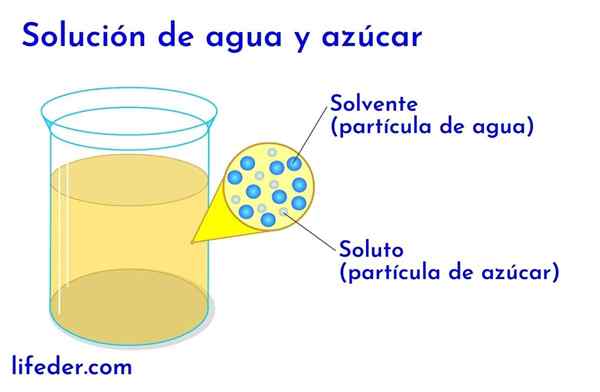 Gelösten und lösungsmittel in Wasser mit Zucker
Gelösten und lösungsmittel in Wasser mit Zucker In jeder Lösung, in der Wasser vorhanden ist, wird dies als Lösungsmittel angesehen. In allen anderen Fällen entspricht das Lösungsmittel der Komponente, die sich in größerer Menge oder in größerem Verhältnis befindet und fast immer eine Flüssigkeit ist. Die anderen in der Lösung vorhandenen Komponenten werden als gelöste Stoffe angesehen.
Schauen wir uns zwei Beispiele an:
- In einer Lösung von Wasser und Zucker ist Wasser das Lösungsmittel und Zucker der gelöste Stoff.
- Der Isopropylalkohol, den wir in der Apotheke kaufen, ist eine Lösung, die durch Wasser und Alkohol gebildet wird. In dieser Lösung ist das Lösungsmittel Wasser, obwohl es sich in einem geringereren Verhältnis als Alkohol befindet.
Eigenschaften und Eigenschaften chemischer Lösungen
Sie sind homogene Gemische
Die Lösungen sind Gemische, bei denen der Lösungsmittel gelöste nicht unterschieden werden kann, entweder für das bloße Auge oder bei Verwendung eines Lupe oder eines Mikroskops.
Sie haben eine einheitliche Zusammensetzung
Dies bedeutet, dass jeder Teil einer Lösung immer die gleichen Komponenten (gelöster und Lösungsmittel) wie die gleiche Konzentration hat.
Kann Ihnen dienen: Cadmium (CD): Geschichte, Eigenschaften, Struktur, verwendetSie sind durch ihre Konzentration gekennzeichnet
Die Konzentration ist eine der wichtigsten Merkmale einer Lösung, da sie viele ihrer Eigenschaften bestimmt.
Sie sind durchscheinend (transparent)
Flüssige Lösungen müssen durchscheinend sein, dh das Licht muss in der Lage sein, sie ohne Verbreitung zu überqueren können.
Sie sind stabil
Eine Lösung, in der der gelöste und das Lösungsmittel nicht aufeinander reagiert. Dies bedeutet, dass es im Laufe der Zeit keine Veränderung unterzogen wird, solange seine Zusammensetzung konstant bleibt (das Lösungsmittel verdunstet beispielsweise nicht).
Die physikalischen und chemischen Eigenschaften unterscheiden sich von denen des Lösungsmittels
Die physikalischen und chemischen Eigenschaften des Lösungsmittels ändern sich beim Mischen mit dem gelösten Stoff. Zum Beispiel haben Lösungen einen größeren Siedepunkt, einen niedrigeren Schmelzpunkt und auch einen hohen osmotischen Druck im Vergleich zu reinem Lösungsmittel.
Sie können durch einige physikalische und chemische Prozesse getrennt werden
Lösungen können nicht durch Filtration, Zentrifugation oder Dekantation getrennt werden. Sie können nur durch physikalische oder chemische Methoden wie Kristallisation, Destillation, Verdunstung, Umkehrosmose und Chromatographie getrennt werden.
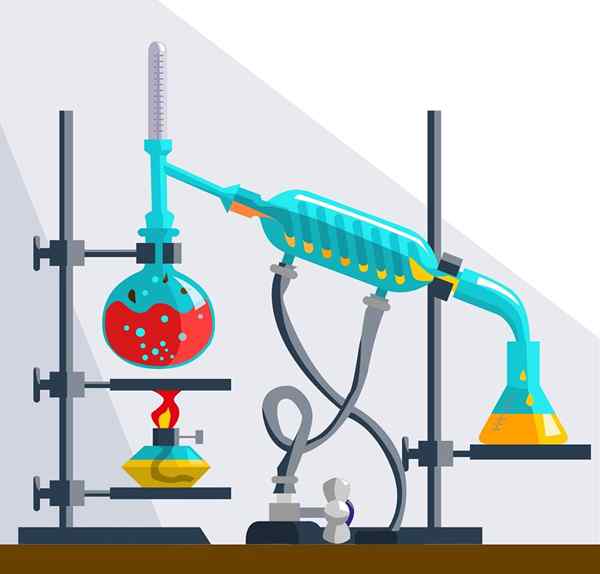 Destillationsinstrumente
Destillationsinstrumente Arten chemischer Lösungen
Chemische Lösungen können nach ihrer Konzentration gemäß ihrer körperlichen Verfassung und der Art des Lösungsmittels klassifiziert werden:
Nach Ihrer Konzentration
- Ungesättigte Lösungen: Sie sind diejenigen, in denen der gelöste gelöste noch nicht seine maximale Konzentration im Lösungsmittel erreicht hat. Aus diesem Grund kann mehr gelöste gelöste gelöst werden, um eine konzentriertere Lösung vorzubereiten.
- Gesättigte Lösungen: Es sind Lösungen, bei denen das Lösungsmittel nicht mehr gelöst auflösen kann. In diesen Fällen gibt es immer einen Teil des gelösten Stoffes, ohne sich aufzulösen. Wenn wir beispielsweise viel Salz zu einem Glas mit Wasser hinzufügen, löst sich ein Teil dieses Salzes nicht auf und bleibt am Boden des Glass.
- Superaturierte Lösungen: Dies sind Lösungen, bei denen mehr gelöste gelöste gelösten als das Lösungsmittel zulässt. Dies kann erreicht werden, indem eine gesättigte Lösung erhitzt wird, um noch mehr gelöste zu lösen und dann langsam auf die Anfangstemperatur abzukühlen. Diese Lösungen sind instabil.
Entsprechend Ihrer körperlichen Verfassung
- Flüssige Lösungen: Sie sind die häufigsten. In dieser Art von Lösungen ist das Lösungsmittel eine Flüssigkeit (wie Wasser, Alkohol, Öl usw.) Aber der gelöste gelöste kann in jedem Zustand (fest, flüssig oder gas) gefunden werden. Einige Beispiele für flüssige Lösungen sind Salzwasser, Wein und Erfrischungsgetränke.
- Solide Lösungen: In diesen Fällen befinden sich sowohl das Lösungsmittel als auch der gelöste Stoff im Festkörperstaat. Die häufigsten Beispiele für diese Art von Lösungen sind Metalllegierungen wie Bronze, Stahl und Messing, aber es gibt auch andere Beispiele wie Glas.
- Gasförmige Lösungen: Wie der Name schon sagt, sind sie homogene Gemische, in denen sich alle Komponenten in einem gasförmigen Zustand befinden.
Nach dem Lösungsmittel
- Wässrige Lösungen: Wenn in einer Lösung das Lösungsmittel Wasser ist, dann wird gesagt, dass es sich um eine wässrige Lösung handelt. Dies sind die häufigsten Lösungen, die im täglichen Leben zu finden sind.
- Alkoholische Lösungen: Das häufigste Lösungsmittel nach Wasser ist Alkohol. Zu den häufigsten Alkoholen gehören Methanol, Ethanol und Isopropylalkohol.
- Lösungen in anderen organischen Lösungsmitteln: Es gibt viele andere organische Verbindungen, die als Lösungsmittel verwendet werden. Dazu gehören einige Alkane, die meisten Ether, flüssige Ketone und andere.
Beispiele für chemische Lösungen
Limonade
Es handelt.
Meerwasser
Meerwasser oder Salzwasser ist eine wässrige Lösung aus Wasser und eine Mischung aus Salzen. Unter diesen Salzen ist Natriumchlorid (NaCl), das als gemeinsames Tischsalz bekannt ist.
Kann Ihnen dienen: Quecksilberoxid (HG2O)Konzentrierter Sirup
Dies ist eine wässrige Lösung, die fast mit Zuckerwasser gesättigt ist.
Kohlensäurehaltiges Wasser
Kohlensäurehaltiges Wasser, auch als Soda bekannt, ist eine wässrige Lösung von gasförmigem Kohlendioxid (CO2) Im Wasser.
Luft
Luft ist eine gasförmige Lösung, bei der Stickstoff als Lösungsmittel, Sauerstoff und andere Gase als gelöste Stoffe angesehen werden kann.
Geklärte Butter
Durch Schmelzen der Butter und entfernen Sie den gesamten Schaum. Dies ist eine Lösung, bei der sowohl das Lösungsmittel als auch die gelösten Stoffe fett sind.
Farbiges Glas
Farbglas sind Festkörperlösungen, bei denen das Lösungsmittel geschmolzene Kieselsäure ist, und gelöste Stoffe sind andere Mineralien, die Glas seine charakteristische Farbe liefern.
Kaffee
Dies ist eine komplexe wässrige Lösung, die viele gelöste gelöste (darunter das Koffein) enthält, die dem Getränk sein charakteristisches Aroma und Geschmack verleihen.
Der Stahl
Stahl ist eine Legierung oder feste Lösung, die durch metallische Eisen und Graphitkohlenstoff gebildet wird.
Blutplasma
Blutplasma ist eine Lösung, die nach dem Zentrifugieren des Blutes erhalten wird, um alle Zellen und andere suspendierte Festkörper zu entfernen. Dies handelt.
Verweise
- Chang, R. und Goldsby, k. (2014). Chemie. 11. Aufl. New York: McGraw-Hill-Ausbildung.
- Lösung (25. Januar 2021). In Wikipedia.Org.
- Brown, t. L., Lemay, e. (2018). Chemie: Die Zentralwissenschaft. 14. Ausgabe. Pearson.
- Krestonosich, s., und andere. (1992). Lösungen. Redaktionelle Miró.
- Vidal, J. ZU. (Herausgeber) (1997). Interaktiver Mentor - thematische Enzyklopädie der Schüler. Ozean Editorial. Barcelona.

