Ester
- 649
- 3
- Medine Kedzierski
 Estere sind organische Verbindungen, die eine Komponente von Carboxylsäure und einen anderen Alkohol haben
Estere sind organische Verbindungen, die eine Komponente von Carboxylsäure und einen anderen Alkohol haben Was sind Ester?
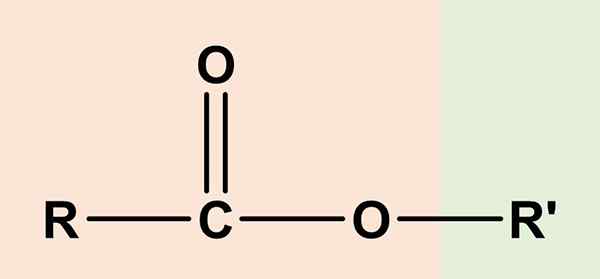
Der Ester Es sind organische Verbindungen mit einer Carbonsäurkomponente und einem anderen Alkohol. Die allgemeine chemische Formel ist RCO2R'' oder RCOOR''. Die rechte Seite, RCOO, entspricht der Carboxylgruppe, während die rechte oder'' Es ist Alkohol. Die beiden teilen sich ein Sauerstoffatom und teilen eine gewisse Ähnlichkeit mit den Ether (ROR ').
Aus diesem Grund das Acetat von Ethyl, ch3Cooch2CH3, Der einfachste Estern wurde als die angesehen Essigsäure- oder Essigsäurether, Und von dort aus der etymologische Ursprung des Namens "Ester". So dass ein Ester im Ersatz des sauren Wasserstoffs der COOH -Gruppe mit einem Alkoholverleih aus einem Alkohol besteht.
Wo sind die Ester?
Aus den Böden der organischen Chemie gibt es viele natürliche Quellen. Der angenehme Geruch von Früchten wie Bananen, Birnen und Äpfeln ist das Produkt der Interaktion von Estern mit vielen anderen Komponenten. Sie werden auch in Form von Triglyceriden in Ölen oder Fetten gefunden.
Unser Körper stellt Triglyceride aus Fettsäuren her, die lange kohlensäurehaltige Ketten und Glycerinalkohol haben. Was einige Ester von anderen unterscheidet, liegt sowohl in R, die Kette der Säurekomponente, wie in r.
Ein Ester mit niedrigem Molekulargewicht muss nur wenige Kohlenstoffe in R und R 'haben, während andere, wie z.
Allerdings sind nicht alle Ester streng organisch. Wenn das Atom der Carbonhel -Gruppe der Carbonylgruppe durch einen Phosphor ersetzt wird, hat RPOOR '' ''. Dies ist als Phosphatester bekannt und ist in der Struktur von DNA entscheidend an Bedeutung.
Wenn ein Atom effizient mit Kohlenstoff oder Sauerstoff wie Schwefel (RSOOR) verbunden werden kann, kann es folglich einen anorganischen Ester bilden.
Estres Eigenschaften
Ester sind keine Säuren oder Alkohole, daher verhalten sie sich nicht als solche. Seine Schmelz- und Siedepunkte sind zum Beispiel niedriger als diejenigen mit ähnlichen Molekulargewichten, aber näher an Werten zu denen der Aldehyde und Ketone.
Butansäure, Cho3CH2CH2COOH hat einen Siedepunkt von 164 ° C, während Ethylacetat, CH3Cooch2CH3, von 77.1. c.
Abgesehen vom jüngsten Beispiel die Siedepunkte von 2-Methylbutane3Ch (Ch3) CH2CH3, Methylacetat, Cho3Cooch3, und 2-Butanol, Cho3,Ch (oh) ch2CH3, Sie sind wie folgt: 28, 57 und 99º C. Die drei Verbindungen haben molekulare Gewichte von 72 und 74 g/mol.
Niedrige molekulare Pesosester sind in der Regel flüchtig und haben angenehme Gerüche, weshalb ihr Inhalt in Früchten ihnen ihre Familienduftstoffe verleiht. Andererseits können sie farblos und geruchsloser kristalline Feststoffe sind, wenn ihre Molekulargewichte hoch sind, oder je nach Struktur können sie Fetteigenschaften aufweisen.
Wasserlöslichkeit
Carboxylsäuren und Alkohole sind normalerweise in Wasser löslich, es sei denn, sie haben einen hohen hydrophoben Charakter in ihren molekularen Strukturen. Das gleiche gilt für Ester. Wenn R oder R 'kurze Ketten sind, kann der Ester mit Wassermolekülen durch Dipol-Dipolo und Streitkräfte der Londoner Streitkräfte interagieren.
Kann Ihnen dienen: Chemische VerbindungDies liegt daran, dass Ester Wasserstoffbrückenakzeptoren sind. Als? Für seine zwei RCOOR -Sauerstoffatome '. Wassermoleküle können Wasserstoffbrücken mit jedem dieser Sauerstoff bilden. Aber wenn die R- oder R -Ketten sehr lang sind, stoßen sie das Wasser in ihrer Umgebung ab und machen es für ihre Auflösung unmöglich.
Ein offensichtliches Beispiel dafür tritt bei Triglyceridester auf. Ihre Seitenketten sind lang und machen Öle und Fette im Wasser unlöslich, es sei denn.
Hydrolysereaktion
Estere können auch mit Wassermolekülen in der sogenannten Hydrolysereaktion reagieren. Sie benötigen jedoch eine Säure- oder Basisumgebung, um den Mechanismus der Reaktion zu fördern:
RCOOR ' + H2ENTWEDER RcoOh + R'oH
(Saure Hälfte)
Das Wassermolekül wird der Carbonylgruppe C = O hinzugefügt. Die Säurehydrolyse wird im Austausch jedes R 'der alkoholischen Komponente durch ein OH aus Wasser zusammengefasst. Beachten Sie auch, wie der Ester in seinen beiden Komponenten "bricht": Carbonsäure, RCOOH und R'OH Alkohol.
RCOOR ' + Oh- => RcoENTWEDER- + R'oH
(Grundmedium)
Wenn die Hydrolyse in einem Basismedium durchgeführt wird, tritt eine irreversible Reaktion auf als Saponifikation. Dies ist sehr beschäftigt und ist der Eckpfeiler bei der Ausarbeitung handwerklicher oder industrieller Seifen.
Der RCOO- Es ist das stabile Carboxylatanion, das elektrostatisch mit dem vorherrschenden Kation in der Mitte assoziiert ist.
Wenn die verwendete Basis NaOH ist, wird das Salz gebildet. Wenn der Ester ein Triglycerid ist, das per Definition drei R -Seitenketten hat, werden drei Fettsäuresalze, Rcoone und Glycerinalkohol gebildet.
Reduktionsreaktion
Ester sind stark oxidierte Verbindungen. Es bedeutet, dass es mehrere kovalente Bindungen mit Sauerstoff hat. Durch die Beseitigung von C-O-Bindungen tritt ein Bruch auf, der die Säure- und alkoholischen Komponenten trennt. Und noch mehr, Säure wird auf weniger oxidierte Weise auf einen Alkohol reduziert:
Rcoor '=> rch2Oh + r'oh
Dies ist die Reduktionsreaktion. Ein starkes Reduktionsmittel wie Lithium und Aluminiumhydrid, Lialh4, und eines sauren Mediums, das die Elektronenmigration fördert. Alkohole sind die kleinsten Formen, dh diejenigen, die weniger kovalente Bindungen mit Sauerstoff haben (nur eine: C-OH).
Die beiden Alkohole, RCH2Oh + r'oh, komm aus den beiden jeweiligen Ketten des ursprünglichen Ester RCOOR '. Dies ist eine Methode zur Synthese von alkoholfreien Alkoholen aus seinen Estern.
Wenn Sie beispielsweise einen Alkohol exotischer Ester herstellen wollten, wäre dies ein guter Weg für diesen Zweck.
Querfindungsreaktion
Ester können in andere verwandelt werden, wenn sie mit Alkoholen in saure oder grundlegende Medien reagieren:
RCOOR ' + R "Oh RcoOder " + R'oH
Esterstruktur
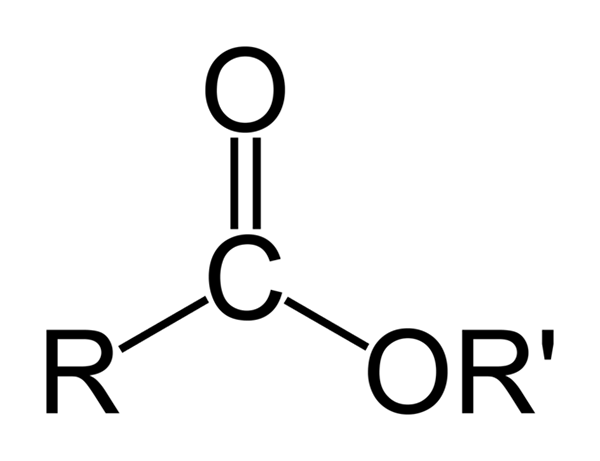 Allgemeine chemische Struktur von organischen Estern. Quelle: Ben Mills über Wikipedia
Allgemeine chemische Struktur von organischen Estern. Quelle: Ben Mills über Wikipedia Das überlegene Bild repräsentiert die allgemeine Struktur aller organischen Ester. Beachten Sie, dass R, die Carbonylgruppe C = O und oder ', ein flaches Dreieck bilden, Produkt der SP -Hybridisierung2 des zentralen Kohlenstoffatoms. Andere Atome können jedoch andere Geometrien übernehmen, und ihre Strukturen hängen von der intrinsischen Natur von R oder R ab.
Kann Ihnen dienen: Nitrate: Eigenschaften, Struktur, Nomenklatur, SchulungWenn r oder r 'einfache Alqulicas -Ketten sind, z. B. vom Typ (wählen Sie aus (wählen Sie2)NCH3, Sie werden im Weltraum Zickzagueada aussehen. Dies ist der Fall von Pentilo Butanoat3CH2CH2Cooch2CH2CH2CH2CH3.
In einem der Kohlenstoffe dieser Ketten könnte jedoch ein Zweig oder eine Unsättigung gefunden werden (C = C, C≡C), die die globale Struktur des Esters modifizieren würde. Und aus diesem Grund variieren seine physikalischen Eigenschaften wie Löslichkeit und ihre Kochen- und Fusionspunkte mit jeder Verbindung.
Beispielsweise haben ungesättigte Fette doppelte Verbindungen in ihren R -Ketten, die die intermolekularen Wechselwirkungen negativ beeinflussen. Infolge.
Wasserstoffbrückenakzeptor
Obwohl sich das Bild des Ester -Skeletts mehr herausstellt, sind es die R- und R -Ketten, die für die Vielfalt in ihren Strukturen verantwortlich sind.
Ein strukturelles Merkmal der Ester ist jedoch dem Dreieck verdient: Sie sind Wasserstoffbrückenakzeptoren. Als? Durch Sauerstoff von Carbonyl- und Alcoxidgruppen (die -or ').
Diese haben freie Elektronenpaare, die teilweise positive Wasserstoffatome von Wassermolekülen anziehen können.
Daher ist es eine spezielle Art von Dipol-Dipol-Wechselwirkungen. Die Wassermoleküle nähern sich dem Ester (wenn die Ketten nicht verhindern und die Brücken gebildet werden C = O-H2Oder, oder oh2-ODER '.
Nomenklatur von Estern
Um einen Ester angemessen zu nennen, ist es notwendig. Auch jeder mögliche Zweig, ein Substituent oder Unsättigung.
Sobald dies erledigt ist, wird der Name des R 'der Alcoxide -Gruppe -oder' das Suffix hinzugefügt -Ilo, Während die Gruppenkette von Carboxilo -Coor R, das Suffix -Ato. Zunächst wird Abschnitt R erwähnt, gefolgt vom Wort 'von' und dann des Namens des Abschnitts r 'Abschnitt'.
Zum Beispiel Cho3CH2CH2Cooch2CH2CH2CH2CH3 Es hat fünf Kohlenstoffe auf der rechten Seite, das heißt, sie sind diejenigen, die R 'entsprechen'. Und auf der linken Seite befinden sich vier Kohlenstoffatome (einschließlich der Carbonylgruppe C = O).
Daher ist R 'eine Pentil -Gruppe und R -A -Butan (um Carbonyl einzubeziehen und die Hauptkette zu berücksichtigen). Um der Verbindung den Namen zu geben, reicht es aus, die entsprechenden Suffixe hinzuzufügen und sie in der richtigen Reihenfolge zu benennen: ButanAto von PentIlo.
Wie man die folgende Verbindung nennt: CH3CH2COOC (Ch3)3? Die Kette -c (Cho3)3 Entspricht dem alquilischen Recto-Butyl-Substituenten. Da die linke Seite drei Kohlenstoffe hat, handelt es sich um ein "Propan". Sein Name ist dann: PropanAto von tert-aberIlo.
Wie werden Ester gebildet??
Veresterung
Es gibt viele Routen, um Ester zu synthetisieren, von denen einige sogar neu sein können. Sie alle konvergieren jedoch die Tatsache, dass das Dreieck des Bildes der Struktur gebildet werden muss, dh die Co-O-Verbindung. Dafür muss es von einer Verbindung aus starten, die zuvor die Carbonylgruppe hat: als Carboxylsäure.
Und was sollte Carbonsäure verknüpft werden? Zu einem Alkohol, sonst hätte es nicht die alkoholische Komponente, die die Ester charakterisiert. Carboxylsäuren erfordern jedoch Wärme und Säure, damit der Reaktionsmechanismus fortgesetzt wird. Die folgende chemische Gleichung repräsentiert die obigen:
Kann Ihnen dienen: Aluminiumhydrid (Alh3): Struktur, Eigenschaften, verwendetRcooh + r'oh rcoor ' + h2ENTWEDER
(Saure Hälfte)
Dies ist bekannt als als Veresterung.
Zum Beispiel können Fettsäuren mit Methanol, Cho3Oh, um ihre Säuren durch Methylgruppen zu ersetzen, daher kann diese Reaktion auch als als angesehen werden Methylierung. Dies ist ein wichtiger Schritt bei der Bestimmung des Fettsäureprofils bestimmter Öle oder Fette.
Esteren aus sauren Chloriden
Eine andere Möglichkeit, Ester zu synthetisieren, sind Acylchloride, RCOCL. In ihnen wird das CL -Atom ersetzt, anstatt eine OH -Hydroxylgruppe zu ersetzen:
Rcocl + r'oh => rcoor ' + hcl
Und im Gegensatz zur Sterifizierung einer Carbonsäure wird Wasser nicht freigesetzt, sondern Salzsäure.
Andere Methoden sind in der Welt der organischen Chemie erhältlich, wie die Oxidation von Baeyer-Villiger, der Peroxysäuren verwendet (RCOOOH).
Estres verwendet
 Esteres werden für verschiedene Dinge verwendet, wie z. B. Kerzenherstellung
Esteres werden für verschiedene Dinge verwendet, wie z. B. Kerzenherstellung Zu den Hauptverwänden von Estern gehören:
- In den Ausarbeitung Kerzen oder Kerzen wie das überlegene Bild. Zu diesem Zweck werden sehr lange Seitenkettenester verwendet.
- Als Medizinkonservierungsmittel oder Nahrung. Dies ist auf die Wirkung der Parabene zurückzuführen, die nichts anderes als Ester von Para-Hydroxibenzoesäure sind. Obwohl sie die Qualität des Produkts behalten, gibt es Studien, die seine positive Wirkung auf den Körper in Frage stellen.
- Sie dienen für die Herstellung künstlicher Düfte, die den Geruch und den Geschmack vieler Früchte oder Blumen nachahmen. So dass Ester in Leckereien, Eis, Parfums, Kosmetika, Seifen, Shampoos vorhanden sind, unter anderem kommerzielle Produkte, die Aromen oder attraktive Aromen verdienen.
- Ester können auch einen positiven pharmakologischen Effekt leisten. Aus diesem Grund hat sich die pharmazeutische Industrie der Synthese von Eestern gewidmet, die aus im Körper vorhandenen Säuren stammen, um eine mögliche Verbesserung der Behandlung von Krankheiten zu bewerten. Aspirin ist eines der einfachsten Beispiele für diese Ester.
- Flüssigester wie Ethylacetat sind ausreichende Lösungsmittel für bestimmte Arten von Polymeren wie Nitrocellulose und eine breite Palette von Harzen.
Beispiele für Ester
Einige weitere Esterbeispiele sind die folgenden:
- Butanato de Pentilo, CH3CH2CH2Cooch2CH2CH2CH2CH3, das riecht nach Albicoque und Birnen.
- Vinylacetat, Cho3Cooch2= Ch2, aus dem das Polyvinylacetatpolymer auftritt.
- Isopentilo Pentanoato, CH3CH2CH2CH2Cooch2CH2Ch (Ch3)2, was den Geschmack von Äpfeln nachahmt.
- Ethylpropanoat, CH3CH2Cooch2CH3.
- Propylmetanoat, HCOoch2CH2CH3.
Verweise
- T.W. Graham Solomons, Craight B. Braten. Organische Chemie. (Zehnte Ausgabe, S. 797-802, 820) Wiley Plus.
- Carey, f. ZU. Organische Chemie (2006) Sechste Ausgabe. MC Graw Hill Editorial-
- Chemistry Librettexts. Nomenklatur der Eser. Erholt von: Chem.Librettexts.Org
- Administrator. (19. September 2015). Ester: seine chemische Natur, Eigenschaften und Verwendung. Entnommen aus: rein-chemisch.com
- Organische Chemie in unserem täglichen Leben. (9. März 2014). Was sind die Verwendung von Estern?? Abgerufen von: Gen2Chemistassignment.Weebly.com
- Chemie.Netz (2018). Beispiele für Ester. Erholt von: Chemics.Netz
- Paz María de Lourdes Cornejo Artaga. Hauptanwendungen von Estern. Genommen aus: UAEH.Edu.mx
- Jim Clark. (Januar 2016). Einführung Ester. Entnommen aus: Chemguide.CO.Vereinigtes Königreich

