Progressives Sublimationskonzept, Prozess und Beispiele
- 849
- 111
- Timo Rabenstein
Der Progressive Sublimation Es ist ein thermodynamischer Prozess, bei dem eine Änderung des endothermen Zustands direkt von einem Feststoff zu einem Gas ohne vorherige Bildung der Flüssigkeit erfolgt. Das Verhalten des Feststoffs unter normalen Bedingungen besteht darin, zu heizen und zu schmelzen; das heißt, schmelzen. In der Sublimation beginnt der Feststoff direkt zu rauchen, ohne dass das auf seine Besetzung auftretende Tropfen auftritt.
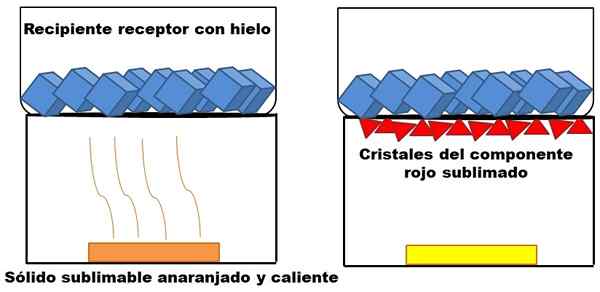
Was im oberen Absatz beschrieben wird. Nehmen wir eine orange feste Mischung (links) an, die sich zu erhitzen beginnt. Die Mischung besteht aus zwei Komponenten oder Feststoffen: einem Gelb und der anderen Rot, dessen Kombination die orangefarbe verursacht.
 Beispiel für die Sublimation eines hypothetischen orange Feststoffs. Quelle: Gabriel Bolívar.
Beispiel für die Sublimation eines hypothetischen orange Feststoffs. Quelle: Gabriel Bolívar. Der unterschwellige rote Feststoff, da eine Flüssigkeit nicht gebildet wird, sondern am Ende des oberen Behälters (rote Dreiecke) abgelagert ist; Derjenige, der Eiswürfel enthält und daher eine kalte Oberfläche bietet. In der Zwischenzeit bleibt der gelbe Feststoff durch Hitze unverändert (gelbes Rechteck).
Rote Dreiecke oder Kristalle werden dank der kalten Oberfläche des Empfangsbehälters (rechts) abgelagert, die seine Temperatur absorbieren. Und selbst wenn es nicht gezeigt wird, muss die Größe seiner Eiswürfel aufgrund der Wärmeabsorption abnehmen. Der gelbe Feststoff ist nicht sublimabel, und wenn er sich früher oder später noch aufwärmt, wird er schmelzen.
[TOC]
Progressives Sublimationskonzept
Verfahren
Es wurde bereits gesagt, dass Sublimation eine endotherme Zustandsänderung ist, da es dafür eine Wärmeabsorption geben muss. Wenn der feste Wärme die Energie nimmt, nimmt die Partikel zu größeren Frequenzen zu.
Wenn diese Schwingungen sehr stark werden, beeinflussen sie die intermolekularen Wechselwirkungen (nicht kovalente Bindungen); Und folglich werden die Partikel früher oder später weitere Entfernungen voneinander abnehmen, bis sie es schaffen, sich frei durch die Regionen des Raums zu fließen und sich freier zu bewegen.
Kann Ihnen dienen: KristallisationBei einigen Feststoffen sind die Schwingungen so stark, dass einige Partikel außerhalb der Struktur "ausgelöst" werden, anstatt in mobilen Clustern zu agglomerieren, die einen Tropfen definieren. Diese Partikel entkommen und integrieren die erste "Blase", die lieber die ersten Dämpfe des sublimierten Feststoffs bilden würde.
Es wird dann nicht über einen Schmelzpunkt, sondern über eine Sublimation gesprochen. Während beide vom amtierenden Druck auf den Feststoff abhängig sind, ist der Point der Sublimation mehr; Daher variiert seine Temperatur mit Druckänderungen deutlich (wie der Fall mit dem Siedepunkt).
Von der festen Struktur zur Gasstörung
Bei Sublimation wird auch gesagt, dass die Systementropie zugenommen hat. Die Energiezustände der Partikel werden durch ihre festen Positionen in der festen Struktur eingeschränkt, um in ihren launenen und chaotischen Richtungen im gasförmigen Zustand einheitlicher zu homogenisieren, wo sie schließlich eine durchschnittliche kinetische Energie erwerben.
Phasendiagramm und dreifacher Punkt
Der Sublimationspunkt hängt vom Druck ab; Denn sonst würden die festen Partikel Wärme absorbieren, um nicht auf den Raum außerhalb des Feststoffs abgefeuert zu werden, sondern um Tropfen zu bilden. Es würde nicht sublimiert, sondern schmelzen oder schmelzen, wie es am üblichsten ist.
Je größer der äußere Druck ist, desto weniger wahrscheinlich wird die Sublimation sein, da der Schmelzen der Feststoff verpflichtet ist.
Aber welche Feststoffe sind sublimabel und welche nicht? Die Antwort liegt in Ihren P -V -Phasen -Diagrammen, wie unten gezeigt:
Es kann Ihnen dienen: Cruise for Crucible: Eigenschaften, Funktionen, verwenden Sie Beispiele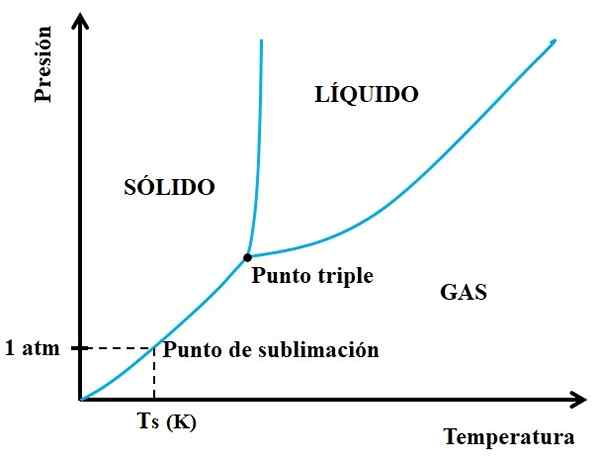 Phasendiagramm für eine hypothetische Substanz. Quelle: Gabriel Bolívar.
Phasendiagramm für eine hypothetische Substanz. Quelle: Gabriel Bolívar. Sie müssen sich zuerst auf den dreifachen Punkt ansehen und die untere Strecke bewegt: diejenige, die die festen und gasförmigen Zustände trennt. Beachten Sie, dass im festen Bereich eine Abnahme des Drucks auftreten muss, sodass Sublimation auftritt (nicht unbedingt 1 atmosphärischer Druck). Ein 1 atm, der hypothetische Substanz wird bei einer Ts -Temperatur untergraben, die in k exprimiert wird.
Je länger und länger der Abschnitt oder die Kurve unter dem dreifachen Punkt sind, desto größer ist die Kapazität des Feststoffs zu Sublim bei verschiedenen Temperaturen; Aber wenn es weit unter 1 atm liegt, wird es mit hohen Lücken benötigt, um Sublimation zu erreichen, damit der Druck reduziert wird (beispielsweise 0,0001 atm).
Bedingungen
Wenn der dreifache Punkt tausende Male niedriger ist als der atmosphärische Druck, wird der Feststoff niemals Ultra -Leben untermessen oder sogar Ultra -Life auftragen (ganz zu schweigen von seiner Anfälligkeit, sich durch die Wirkung von Wärme zu zersetzen).
Wenn dies nicht der Fall ist, werden die Sublimationen mittels mäßig durchgeführt und die Feststoff zum Vakuum einreichen, damit ihre Partikel leichter entkommen, ohne dass so viel Wärme absorbiert werden muss.
Die Sublimation wird sehr wichtig, wenn sie besonders Feststoffe mit hohem Dampfdruck sind. das heißt, der Druck im Inneren, die Reflexion der Effizienz seiner Wechselwirkungen. Je größer sein Dampfdruck, desto geruchlicher ist er und auch sublimierbarer.
Beispiele
Solide Reinigung
Das Bild des orange Feststoffs und seiner sublimierbaren rötlichen Komponente ist ein Beispiel dafür, was Sublimation in Bezug auf feste Reinigung darstellt. Rote Dreiecke können so oft nach Bedarf wiederhergestellt werden, bis eine hohe Reinheit garantiert ist.
Kann Ihnen dienen: AlkoholeDiese Technik wird hauptsächlich mit duftenden Feststoffen verwendet. Zum Beispiel: Kampfer, Koffein, Benzoine und Mentol.
Unter anderem, die Sublimation unterliegen können.
Kristallsynthese
Die Sublimation kehrt zu roten Dreiecken zurück und bietet eine Alternative zur konventionellen Kristallisation. Kristalle werden nicht mehr aus einer Lösung synthetisiert, sondern mit Mitteln.
Nehmen wir an, wenn sie rote Quadrate haben, wird das Wachstum der Kristalle diese Geometrie beibehalten und sollte nicht dreieckig werden. Die roten Quadrate wachsen allmählich, wenn Sublimation stattfindet. Es handelt sich jedoch um einen operativen und molekularen Komplex, in dem viele beteiligte Variablen gesehen werden.
Beispiele für synthetisierte Kristalle durch Sublimation sind: Siliziumkarbid (sic), Graphit, Arsen, Selen, Phosphor, Aluminiumnitruro (ALN), Cadmiumsulfid (CDS), Zink Seleniuro (Znse), Mercury -Emerfid (HGI (HGI) (HGI)2), unter anderem Graphen.
Beachten Sie, dass sie wirklich zwei gedruckte Phänomene sind: progressive Sublimation und Ablagerung (oder umgekehrte Sublimation); Der Dampf wandert aus dem Feststoff in kältere Regionen oder Oberflächen aus, um schließlich in Form von Kristallen abzulegen.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Wikipedia. (2019). Sublimation (Phasenübergang). Abgerufen von: in.Wikipedia.Org
- Jones, Andrew Zimmerman. (27. Januar 2019). Sublimation. Erholt von: thoughtco.com
- Sheila Morrissey. (2019). Was ist Sublimation in der Chemie? - Definition, Prozess und Prüfungen. Lernen. Erholt von: Studium.com
- Elsevier b.V. (2019). Sublimationsmethode. Scientedirect. Abgerufen von: Scientedirect.com
- « Ursprung der Flogisten -Theorie, Prinzipien und Einwände
- Soziale Dimension ist Mensch, Bildung, Wissen, Recht, Gesundheit »

