Aluminiumsulfat (Al2 (SO4) 3)

- 4015
- 929
- Jasmine Kupprion
 Weiße Aluminiumsulfatkristalle
Weiße Aluminiumsulfatkristalle Was ist Aluminiumsulfat?
Er Aluminiumsulfat Es ist eine anorganische Formel -Aluminiumsalz zum Salz2(SW4)3, was normalerweise als weißer Feststoff aus glänzenden Kristallen auftritt. Die Farbe der Verbindung wird durch die Eisenkonzentration und jede andere Unreinheit beeinflusst. Es gibt zwei Haupttypen von Aluminiumsulfat: A und B.
Es ist ein sehr lösliches Salzsalz, und in der Natur ist es selten, es in seiner wasserfreien Form zu finden. Es ist normalerweise in Form von Octadecahydrat -Aluminiumsulfat hydratisiert [zu2(SW4)3.18h2Oder] oder Hexadecahydrate [zu2(SW4)3.16h2ENTWEDER].
Es kann auch Doppelsalze mit Kalium und mit Ammonium bilden, die als Lichter bekannt sind. Zum Teil kann dies auf die Affinität von Wasser innerhalb der Hydraten zurückzuführen sein, um andere Ionen zusätzlich zu Aluminium zu halten.
Chemische Struktur von Aluminiumsulfat
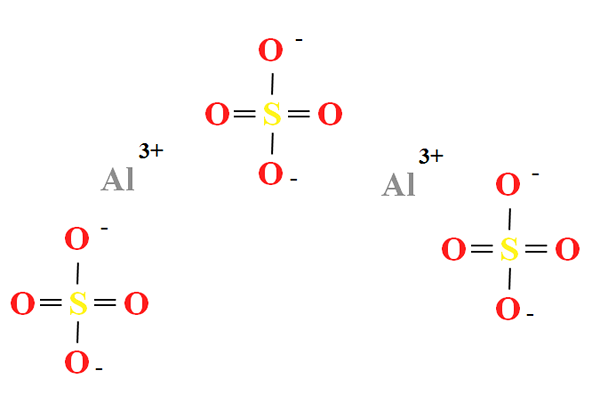 Chemische Struktur von Aluminiumsulfat. Quelle: Gabriel Bolívar
Chemische Struktur von Aluminiumsulfat. Quelle: Gabriel Bolívar Aluminiumsulfat hat einen Anteil von zwei Kationen an die3+ für drei Anionen so42- (überlegenes Bild), das direkt in seiner chemischen Formel an die beobachtet werden kann2(SW4)3.
Beachten Sie, dass3+ Sie sind grau, während die SOS42- Sie sind gelb (für das Schwefelatom) und rot (durch Sauerstoffatome).
Die dargestellte Struktur entspricht der wasserfreien Form von Al2(SW4)3, Da kein Wassermolekül mit den Ionen interagiert. In seinen Hydraten kann Wasser jedoch von den positiven Zentren von AL angezogen werden3+, oder für die negative Tetraeder von SO42- durch Wasserstoffbrücken (hah-o-so so32-).
Der Al2(SW4)3∙ 18h2Oder zum Beispiel enthält es 18 Wassermoleküle in seiner festen Struktur. Einige von ihnen sind möglicherweise in direktem Kontakt mit ihm3+ oder mit dem SOS42-. Mit anderen Worten: Aluminiumsulfat kann internes oder externes Koordinationswasser haben.
Außerdem kann seine Struktur andere Kationen wie den Glauben beherbergen3+, N / A+, K+, usw. Aber dafür ist das Vorhandensein von mehr unter Anionen notwendig42-, Um den Anstieg der positiven Belastungen aufgrund von Metallverunreinigungen zu neutralisieren.
Aluminiumsulfat kann viele Strukturen haben, obwohl seine Hydrate dazu neigen, das monoklinische kristalline System zu übernehmen.
Physikalische und chemische Eigenschaften
Aspekt
Es wird als Feste mit blinkenden weißen Kristallen, Granulat oder Staub präsentiert.
Molekulargewicht
342,31 g/mol (wasserfrei).
Geruch
Es ist Toilette.
Geschmack
Süßer Geschmack, mäßig adstringierend.
Schmelzpunkt
770º C Anhydra Form (86,5º C Octadecahydratform).
Wasserlöslichkeit
31,2 g/100 ml bei 0º C; 36,4 g/100 ml bei 20 ° C und 89 g/100 ml bei 100 ° C.
Dichte
2,67 bis 2,71 g/cm3.
Löslichkeit
Etwas löslich in Ethylalkohol.
Dampfdruck
Im Wesentlichen Null.
Stabilität
Luft in der Luft.
Zersetzung
Bei erhitztem Erhitzen kann es ungefähr bis zu seinem Schmelzpunkt durch emittieren, insbesondere Schwefeloxid, ein giftiges Gas.
Korrosivität
Aluminiumsulfatlösungen sind für Aluminium korrosiv. Auch die Verbindung kann Metalle in Gegenwart von Feuchtigkeit korrodieren.
Kann Ihnen dienen: GluconeogenesePKA
3.3 bis 3.6. Und sein pH -Wert beträgt 2,9 oder mehr in einer wässrigen Lösung bei 5%.
Aluminiumsulfat verwendet
Wasserkoagulation oder Flockung
- Wenn Aluminiumsulfat mit Wasser (trinkbar, serviert oder Abfall) gemischt wird, verursacht er Aluminiumhydroxid, das Komplex mit Verbindungen und Partikeln in Lösung bildet.
- Aluminiumsulfat wird auch zur Reinigung des Poolwassers verwendet, wodurch sie attraktiver für die Verwendung.
- Durch die Verwendung von Aluminiumsulfat wird ein Wasser ohne Trübung und Farbe erreicht, wodurch seine Topf durch Erleichterung der Wasserreinigung erhöht wird. Leider kann diese Reinigungsmethode zu einer leicht erhöhten Aluminiumkonzentration im Wasser führen.
- Aluminium ist ein sehr giftiges Metall, das sich in Haut, Gehirn und Lunge ansammelt und schwerwiegende Störungen verursacht. Darüber hinaus ist nicht bekannt, welche Funktion in Lebewesen erfüllt.
- Die Europäische Union verlangt, dass die maximal zulässige Grenze des Aluminiums im Wasser 0,2 mg/l nicht überschreitet. Andererseits verlangt die US-amerikanische Umweltschutzbehörde, dass die maximale Wasserverschmutzungsgrenze mit Aluminium 0,05-0,2 mg/l nicht überschreitet.
- Die Behandlung von Gewässern, die mit Aluminiumsulfat verwendet oder serviert werden.
Ich benutze als Tintenmordant und in der Ausarbeitung des Papiers
- Aluminiumsulfat wurde als Unterkunft von Farbstoffen oder Tinten verwendet, die beim Aussehen des Textilmaterials beitragen. Die Befestigungsaktion ist Al (OH) zurückzuführen3, deren gallertartige Konsistenz mit der Adsorption von Farbstoffen gegenüber Textilien zusammenarbeitet.
- Obwohl es von ungefähr 2000 bis verwendet wurde.C. Mit dem beschriebenen Zweck erfordern nur organische Farbstoffen unter Eindämmen. Synthetische Farbstoffe hingegen verlangen nicht, dass Unterkunft ihre Funktion erfüllen.
- Es wurde aus der Papierherstellung vertrieben, wird jedoch immer noch bei der Ausarbeitung von Papierzellstoff verwendet. Entfernen Sie Ihre Verunreinigungen, sowie es wurde verwendet, um Materialien zu verbinden, Lasten zu neutralisieren und Kolophonie zu kalibrieren.
Industrielle Verwendungszwecke
- Es wird in der Bauindustrie verwendet, um die konkrete Einstellung zu beschleunigen. Zusätzlich wird es für die Wasserdichtung von Konstruktionen verwendet.
- In der Seifen- und Fettindustrie wird sie in der Glycerinproduktion verwendet.
- In der Ölindustrie zur Ausarbeitung der synthetischen Katalysatoren, die sie während ihres Betriebs verwenden.
- Es wird in der pharmazeutischen Industrie als adstringierend bei der Herstellung von Arzneimitteln und Kosmetika verwendet.
- Eingriffen in die Ausarbeitung von Farbstoffen wie Carmine. Es wird auch als Farbstoff bei der Herstellung von synthetischen Gummi -Buttadien -Stretus verwendet.
- In der Zuckerherstellungsindustrie wird es als Reiniger des Zuckerrohrmelasses verwendet.
- Es wird zur Herstellung von Deodorants verwendet, da es die Verengung der Kanalkanäle der Schweißdrüsen verursacht und so die Ansammlung von Schweiß einschränkt, ein Mittel, das für das Wachstum der Bakterien erforderlich ist, die den schlechten Geruch verursachen.
- Es wird im Lederbräunen verwendet, ein für den Gebrauch erforderlich. Zusätzlich wird es zur Herstellung von Düngemitteln verwendet.
- Es wird als Additiv bei der Ausarbeitung von Gemälden, Klebstoffen und Dichtungsmitteln sowie Reinigungs- und Pflegeprodukten von Möbeln verwendet.
Medizinische und therapeutische Anwendungen
- Aluminiumsulfat ist ein Immun -Adjuvans. Daher erfüllt es die Funktion der Verarbeitung der Antigene so, dass sie, wenn sie an ihrem Wirkstätten freigesetzt werden.
- Freund und BCG -Adjuvans sowie die anderen Adjuvantien, einschließlich Endogene wie Interleukine, sind für Antigene nicht spezifisch, was eine Zunahme des Immunwirkungsradius ermöglicht. Dies hat die Ausarbeitung von Impfstoffen gegen zahlreiche Krankheiten ermöglicht.
- Die Koagulanswirkung von Aluminiumsulfat hat die Eliminierung zahlreicher Viren in behandeltem Wasser wie der Beta, MS2, T4 und P1 ermöglicht, unter anderem. Die Ergebnisse zeigen, dass die Behandlung von Wasser mit Aluminiumsulfat eine Inaktivierung solcher Viren erzeugt.
- Aluminiumsulfat wird in einem Stab oder als Staub bei der Behandlung kleiner oberflächlicher Wunden oder Abrasionen verwendet, die durch Rasur erzeugt werden.
- Es wird bei der Herstellung von Aluminiumacetat verwendet, die bei der Behandlung einiger Ohrenbedingungen verwendet wird. Es wurde auch ohne signifikanten Erfolg verwendet, um die Folgen von Feuerameisenbissen zu lindern.
- Aluminiumsulfatlösungen werden bei einer Konzentration von 5% bis 10% bei der lokalen Behandlung von Geschwüren verwendet, die die Kontrolle ihrer Sekrete ermöglichen.
- Die adstringierende Wirkung von Aluminiumsulfat bezieht.
Andere Verwendungen
- Aluminiumsulfat hilft bei der Kontrolle des übermäßigen Algenwachstums in Teichen, Seen und Wasserströmungen. Es wird auch zur Beseitigung von Mollusken verwendet, darunter die spanische Schnecke.
- Gärtner tragen diese Verbindung an, um alkalische Böden zu säueren. In Kontakt mit ihrem Wasser, Aluminiumsulfat zersetzt sich in Aluminiumhydroxid und verdünnte Schwefelsäure. Dann schlägt Aluminiumhydroxid aus und verbleibte Schwefelsäure.
- Die Ansäuerung von Böden aufgrund von Schwefelsäure wird auf sehr kreative Weise aufgrund der Existenz einer Pflanze namens Hortensie sichtbar gemacht, deren Blüten in Gegenwart eines sauren Bodens blau werden. Das heißt, sie sind sensibel und reagieren auf pH -Veränderungen.
- Aluminiumsulfat interveniert in der Ausarbeitung eines Schaums zur Bekämpfung und Kontrolle des Feuer2. Dieser Gas blockiert den Zugang des O2 an die Verbrennungsstelle des Materials und folglich die Entwicklung des Feuers, das entwickelt wurde.
Aluminiumsulfatproduktion
Aluminiumsulfat wird durch Reaktion einer an Aluminium reichhaltigen Verbindung wie Bauxit -Mineral mit Schwefelsäure bei hohen Temperaturen synthetisiert. Die folgende chemische Gleichung repräsentiert die Reaktion:
Zum2ENTWEDER3 + H2SW4 -> Al2(SW4)3 + 3 h2ENTWEDER
Aluminiumsulfat kann sich auch durch eine Neutralisationsreaktion zwischen Aluminiumhydroxid und Schwefelsäure gemäß der folgenden Reaktion bilden:
2 bis (OH)3 + 3 h2SW4 + 12 h2Oder -> zu2(SW4)3.18h2ENTWEDER
Schwefelsäure reagiert mit Aluminium zur Bildung von Ammoniumsulfat und der Freisetzung von Wasserstoffmolekülen in Form von Gas. Die Reaktion wird wie folgt schematisiert:
2 bis +3 h2SW4 -> Al2(SW4)3 + 3 h2
Arten von Aluminiumsulfat
Aluminiumsulfat wird in zwei Typen eingeteilt: Typ A und Typ B. Im Aluminiumsulfat vom Typ A sind Feststoffe weiß und haben eine Eisenkonzentration von weniger als 0,5%.
Bei Aluminiumsulfat vom Typ B sind Feststoffe braun und haben eine Eisenkonzentration von weniger als 1,5%.
Es gibt Aluminiumsulfat -produzierende Branchen, die unterschiedliche Kriterien für die Klassifizierung haben. Somit berichtet eine Branche über die Herstellung des Aluminiumsulfattyps auf eine maximale Konzentration von 0,1% Eisen als Eisenoxid.
Während sie für Typ B eine maximale Eisenkonzentration von 0,35% angeben.
Aluminiumsulfattoxizität
- Aluminiumsulfat ist eine Verbindung, die ihre toxische Wirkung durch Kontakt mit Staub ausübt und so Hautreizungen verursacht. In Fällen, in denen der Kontakt häufig ist, Dermatitis.
- In den Augen verursacht es starke Reizungen und erzeugt sogar dauerhafte Verletzungen.
- Seine Inhalation erzeugt Reizungen von Nase und Hals, die Husten und Carraspera verursachen können.
- Seine Aufnahme verursacht Magenreizungen, Übelkeit und Erbrechen.
- Es gibt toxische Wirkungen, die, obwohl sie nicht direkt auf Aluminiumsulfat zurückzuführen sind, indirekt für ihre Verwendung gelten. Dies ist der Fall bestimmter toxischer Wirkungen von Aluminium, die durch die Verwendung von Aluminiumsulfat bei der Wasserreinigung verursacht werden.
- Patienten, die unter Verwendung von Salzen, die durch die Verwendung von Aluminiumsulfat in gereinigtem Wasser hergestellt wurden. Unter diesen Störungen erwähnen wir Anämie, Dialysedemenz und eine Zunahme von Knochenerkrankungen.
Verweise
- Wikipedia. (2018). Aluminiumsulfat. Genommen von: in: in.Wikipedia.Org
- Industriearis. Aluminiumsulfat Typ A und B. Genommen von: aris.com.Sport
- Christopher Boyd. (9. Juni 2014). Top Industrial Us für Aluminiumsulfat. Genommen von: ChemService.com
- Pubchem. (2018). Aluminiumsulfat wasserfrei. Entnommen aus: Pubchem.NCBI.NLM.NIH.Regierung
- Chemische Andesia. (20. August 2009). Aluminiumsulfat -Sicherheitsblatt. [PDF]. Genommen von: Andesia.com
- Chemisches Buch. (2017). Aluminiumsulfat. Entnommen aus: Chemikalbuch.com

