Ammoniumsulfat
- 1605
- 174
- Joy Hort
Wir erklären, was Ammoniumsulfat, seine chemische Struktur, physikalische und chemische Eigenschaften und verwendet
Was ist Ammoniumsulfat?
Er Ammoniumsulfat Es ist ein ternäres und ammoniak anorganisches Salz aus Schwefelsäure. Seine chemische Formel ist (NH4)2SW4. Daher sagen stöchiometrische Anteile, dass für jedes Sulfatanion zwei Ammoniumkationen mit ihm interagieren. Dies ermöglicht die Salzneutralität ((+1) ∙ 2 + (-2)).
Seine Nomenklatur ist auf die Tatsache zurückzuführen, ein Salz zu sein, das von H abgeleitet ist2SW4, Ändern des "Harric" -Suffix für "ATO". Somit werden die beiden anfänglichen Protonen durch NH ersetzt4+, Produkt der Reaktion mit Ammoniak (NH3). Die chemische Gleichung für ihre Synthese lautet also: 2 NH3 + H2SW4 => (NH4)2SW4
Ammoniumsulfat wird auch durch Reaktion von Ammoniumcarbonat mit Calciumsulfat hergestellt: (NH4)2CO3 + Fall4 => (NH4)2SW4 + Dieb3, Ausfällung des Carbonat von Calico, der von der verbleibenden Flüssigkeit getrennt ist.
Ammoniumsulfat ist Stickstoff- und Schwefelspeicherung, beide unverzichtbar in der Bodenchemie und Düngemittel.
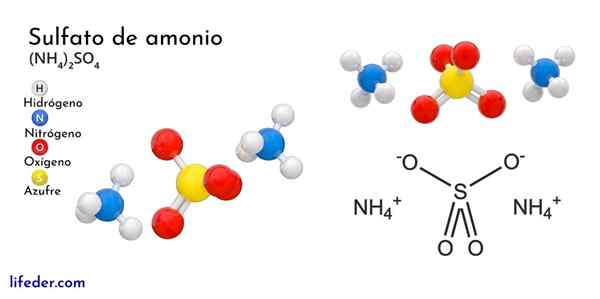
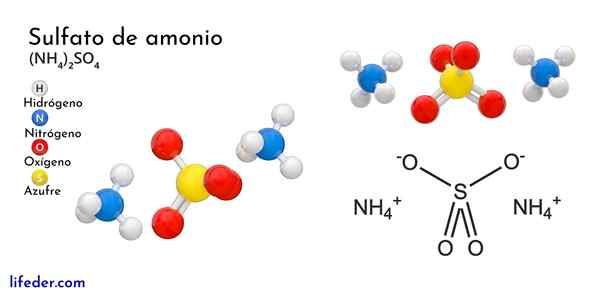
Chemische Struktur von Ammoniumsulfat

Das überlegene Bild zeigt die molekularen Geometrien der NH -Ionen4+ Und so42-. Die roten Kugeln entsprechen Sauerstoffatomen, weiß bis Wasserstoffatomen, blau bis Stickstoffatom und gelb bis Schwefelatom.
Beide Ionen können als zwei Tetraeder betrachtet werden, wodurch drei Einheiten mit einer ortorrombischen kristallinen Anordnung interagiert werden. Das Sulfatanion ist so42- Und es ist in der Lage, vier Wasserstoffbrücken sowie das NH -Kation zu spenden oder zu akzeptieren4+.
Ammoniumsulfateigenschaften
Molekulargewicht
132,134 g/mol.
Es kann Ihnen dienen: Verhältnis von Chemie und Technologie zu Menschen, Gesundheit und UmweltAussehen
Weiß feste. Weiße oder braune ortorrhrombische Kristalle, abhängig von Verunreinigungsniveaus.
Geruch
Toilette.
Schmelzpunkt
280 ºC. Dieser Schmelzpunkt unter anderen ionischen Verbindungen liegt daran.
Löslichkeit
76,4 g/100 g Wasser bei 25 ° C. Diese Affinität zum Wasser ist auf die große Kapazität ihrer Moleküle zurückzuführen, um die Ammoniumionen zu lösen. Andererseits ist es in Aceton und Alkohol unlöslich; Das heißt in weniger polaren Lösungsmitteln als in Wasser.
Dichte
1,77 g/cm3 bei 25 ºC.
Dampfdruck
1.871 kPa bei 20 ° C.
Flammpunkt
26 ºC.
pH
5,0 - 6,0 (25 ºC). Lösung 1 m). Ein leicht saurer pH -Wert ist auf die NH -Hydrolyse zurückzuführen4+ In Wasser, produzieren h3ENTWEDER+ bei niedrigen Konzentrationen.
Stabilität
Stabil unter angemessenen Umgebungsbedingungen. In Kontakt mit starken Oxidationsmitteln kann es in Brand setzen.
Zersetzung
Es beginnt sich bei 150 ° C zu zersetzen und giftige Schwefeloxid -Dämpfe, Stickoxid und Ammonium freizusetzen.
Korrosion
Greift kein Eisen oder Aluminium an.
Verwendung von Ammoniumsulfat
In der Landwirtschaft
- Ammoniumsulfat wird als Dünger in alkalischen Böden verwendet. Ammoniumsalz hat 21 % Stickstoff und 24 % Schwefel in seiner Zusammensetzung. Es gibt jedoch Verbindungen, die eine Menge Stickstoff höher als Ammoniumsulfat liefern. Der Vorteil des letzteren ist seine hohe Schwefelkonzentration.
- Schwefel ist für die Proteinsynthese wesentlich, da mehrere Aminosäuren - wie Cystin, Methionin und Cystein - Schwefel aufweisen. Aus diesen Gründen ist Ammoniumsulfat weiterhin einer der wichtigsten Düngemittel.
- Es wird in Weizen-, Mais-, Reis-, Baumwoll-, Kartoffel-, Hanf- und Obstbäumen verwendet.
- Der pH -Wert von alkalischen Böden für ihren Beitrag zum Nitrifikationsprozess, der von den Mikroben durchgeführt wird. Ammonium wird verwendet (NH4+) Nitrat produzieren (nein3-) und veröffentlichen H+: 2nh4+ + 42 => 2no3- + 2H2O + 4h+. Die Zunahme der Wasserstoffkonzentration verringert den pH -Wert von alkalischen Böden und ermöglicht mehr Gebrauch.
- Zusätzlich zu seiner Verwendung als Dünger wirkt Ammoniumsulfat als Adjuvant von löslichen Insektiziden, Herbiziden und Fungiziden, die auf Erntesprühteile besprüht werden.
- Sulfat ist in der Lage, im Boden und im Bewässerungswasser vorhandene Ionen zu entführen, die für das Leben bestimmter Krankheitserreger notwendig sind. Unter den Ionen, die das Ammoniumsulfat erfasst, sind die CA2+, Der Mg2+, Glaube2+ und Glaube3+. Diese Wirkung verbessert den mikrobiziden Effekt der oben genannten Wirkstoffe.
Als analytisches Reagenz
Ammoniumsulfat wirkt als fälschendes Mittel in der elektrochemischen Analyse, inmitten der mikrobiologischen Kultur und in der Herstellung von Ammoniumsalzen.
Bei Niederschlag und Proteinisolierung
Ammoniumsulfat wird bei Isolierung und Proteinreinigung, insbesondere Plasma. Dem Plasma wird eine Menge Ammoniumsulfat zugesetzt, um es in eine bestimmte Konzentration zu bringen; Somit wird die Ausfällung einer Proteingruppe verursacht.
Der Niederschlag durch Zentrifugation wird gesammelt, und der Überstand wird eine zusätzliche Menge Ammoniumsulfat zugesetzt, und zu einer neuen Konzentration wird die Ausfällung einer anderen Proteingruppe erzeugt.
Die Wiederholung des vorherigen Prozesses ermöglicht nacheinander das Abrufen verschiedener Plasmaproteinfraktionen.
Bevor die neuen Technologien der molekularen Biologie auftreten, ermöglichte dieses Verfahren die Isolierung von Plasmaproteinen von großer Bedeutung in der Medizin, zum Beispiel: Immunglobuline, Gerinnungsfaktoren usw.
In der Industrie
Ammoniumsulfat wirkt sich durch die Verzögerung des Feuersbeginns in der Textilindustrie. Es wird als Additiv in der Electroenchapado -Branche verwendet. Es wird auch zur Herstellung von Wasserstoffperoxid, Ammoniumchlorid usw. verwendet.
Andere Verwendungen
- Ammoniumsulfat wird als regulatorisches Mittel des osmotischen Drucks und als fälschendes Mittel von Salzen verwendet.
- In Form von Ammoniumsulfatlauril verringert es die Oberflächenspannung des Wassers und ermöglicht so die Trennung von Schadstoffen durch eine Erhöhung der Wasserhärte.
- Ist ein antikorrosives Mittel.
- Es wird als Lebensmittelzusatz verwendet, der die Säure in Mehlteig und Brot reguliert.
- « Mission und persönliches Vision Konzept, wie man sie macht, Beispiele
- Spätere Salze Was sind Nomenklatur, Eigenschaften, Beispiele »