Calciumsulfat (Fall4) Chemische Struktur, Eigenschaften, verwendet
- 825
- 4
- Nick Laurén
Was ist Calciumsulfat?
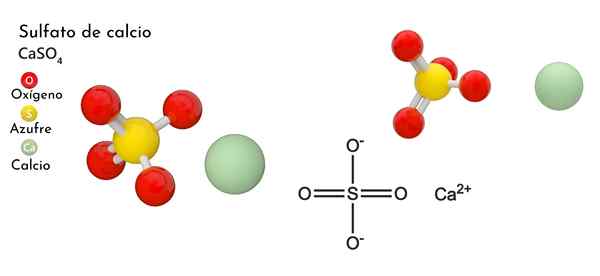
Er Calciumsulfat Es ist ein ternäres Kalziumsalz, Alkalinother Metall (MR. Scholambara), Schwefel und Sauerstoff. Seine chemische Formel ist ein Fall4, Was bedeutet das für jedes Kation ca2+ Es gibt so ein Anion42- mit diesem interagieren. Bildet eine Verbindung mit breiter Verteilung in der Natur.
Die am häufigsten vorkommenden Formen sind der Fall4· 2H2Oder (der Gips) und der wasserfreie Formfall4 (Der Anhydrit). Es gibt auch eine dritte Form: den Gips- oder Gips von Paris, erzeugt durch die Erwärmung des Gips (der Hemidrate, Fall4· 1/2h2ENTWEDER).
Calciumsulfat ist eine sehr nützliche Verbindung in der Arbeit des menschlichen Wesens, da es in zahlreichen Funktionen verwendet wird, die Straßenkonstruktion, Zuhause und sogar Knochenreparatur umfassen.
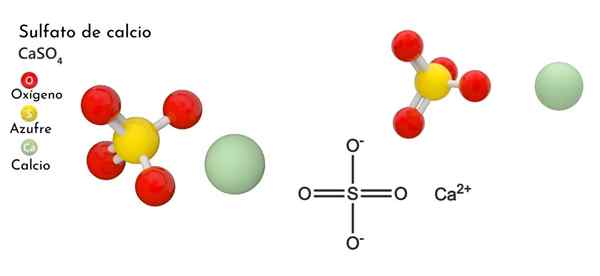
Chemische Struktur von Calciumsulfat

Im oberen Bild ist die ortorrombische einheitliche Zelle für den Fall gezeigt4. Hier wird angenommen, dass Wechselwirkungen rein elektrostatisch sind; Das heißt2+ Sie ziehen tetraedrische Anionen so an42-.
Allerdings die CA2+ Es ist sehr anfällig für Koordinaten und bildet polyedrische Strukturen um es herum. Für was ist das? Zur elektronischen Verfügbarkeit von Kalzium, um Elektronen grundlegender oder negativer Spezies zu akzeptieren (wie die Atome von o so42-).
In Anbetracht des vorherigen Punktes jetzt die CA -Ionen2+ Sie akzeptieren Dativverbindungen (bereitgestellt vom O) und die Einheitszelle wird transformiert, wie durch das untere Bild angezeigt:
Folglich wird Polyheedro CAO gebildet8 (Die grüne Sphäre von CA2+ umgeben von acht roten Kugeln oder Tetraeder so4 schließen). Calcium -Polyeder und Sulfat Tetraeder; Dies ist die kristalline Struktur des Gehäuses4 wasserfrei.
Es kann Ihnen dienen: Knacker Beraral: Was ist, Merkmale, wofür ist esZusätzlich, wenn die Kristalle hydratisiert werden, bilden Sie das di -hydrierte Salz oder das Hemidrate (Fall4· 1/2 h2O)- Die Struktur wird verzögert, um Wassermoleküle einzubauen.
Diese Moleküle können durchsetzt und mit Calcium koordiniert werden; Das heißt, sie ersetzen ein oder zwei Sulfatgruppen.
Andererseits integriert nicht das gesamte Wasser das Cao -Polyeder8. Einige bilden andererseits Wasserstoffbrücken mit Sulfaten. Diese dienen als Gewerkschaft für zwei Abschnitte in Zickzack, Produkte der Anordnung von Ionen im Glas.
Calciumsulfateigenschaften
 Calciumsulfat -Aussehen
Calciumsulfat -Aussehen Molekularformel
Fall4 · NH2O.
Wasserfreies Molekulargewicht
136.134 g/mol.
Geruch
Es ist Toilette.
Aspekt
Im Falle von Anhydrit sieht es aus wie ein weißes ortorrombisches oder monoklines Festpulver. Die Kristalle haben eine variable Farbe: Sie können weiß oder mit einem bläulich-, grau- oder rötlichen Farbstoff sein; Es kann auch Ziegelrot sein.
Dichte
2,96 gr/cm3 (wasserfreie Form). 2,32 gr/cm3 (Dihydratform).
Schmelzpunkt
2840 ºF). Charakteristisch für die starken elektrostatischen Wechselwirkungen zwischen den zweiwertigen Ionen Ca2+ Und so42-.
Löslichkeit
0,2-0,3 % in Wasser bei 25 ° C. Es ist wenig löslich in Wasser und unlöslich in Ethanol.
Stabilität
Stabil bei Raumtemperatur.
Verwendung von Calciumsulfat
In Bau und Kunst
Es wird bei der Ausarbeitung des Stucks an Frisar an den Wänden der Häuser und anderer Konstruktionen verwendet, die zu seiner Verschönerung beitragen. Darüber hinaus werden Medienformen auf Dächern und Fenstern gemacht. Der Gips befindet sich auch im Rush Himmel.
Calciumsulfat wird verwendet, um das Problem zu lösen, das bei der Hydratation von Beton auftritt und somit am Bau von Straßen, Wegen usw. zusammenarbeitet.
Es kann Ihnen dienen: Elektrophile: Reaktionen, Beispiele, ElektrophylitätMit dem Gip.
Therapeutika
Tierarzt
Experimentell wurden im Tierarzt sterile Calciumsulfatstücke verwendet.
Der Gips oder der Pariser Gips kann verwendet werden, um Knochendefekte für ihre einzigartige Fähigkeit zu reparieren, die Osteogenese zu stimulieren. X -RAY- und TECHNECIUM -Studien (TC99M) Medronat.
Eine Knochenregeneration wurde bei sechs Hunden in einem Zeitraum von 4 bis 6 Monaten nachgewiesen. Calciumsulfat begann 1957 in diesem Feld in Form von Paris Gips -Tabletten verwendet, um Hundeknochen zu füllen.
Der Knochenersatz von Calciumsulfat ist vergleichbar mit dem, der im autogenen Knochen beobachtet wurde.
Ruhaimi (2001) angewendet Calciumsulfat in einen neu zerstörten Kaninchenkieferknochen, der eine Zunahme der Osteogenese und Knochenverkalkung beobachtet.
Medizin
Calciumsulfat wird in der Medizin eingesetzt, um die Gelenke zu immobilisieren, die Versetzungen und in gebrochenen Knochen erlitten haben, und zusätzlich als Hilfsmittel bei der Ausarbeitung von Tabletten verwendet.
Zahnheilkunde
In der Zahnmedizin wird es als Grundlage für die Ausarbeitung der Zahnprothesen in Restaurationen und Eindrücken der Zähne verwendet.
In der Lebensmittelausarbeitung
Es wird als Gerinnungsmittel bei der Ausarbeitung des Tofu verwendet, ein Lebensmittel aus Soja und großem Verbrauch in den östlichen Ländern als Fleischersatz. Darüber hinaus wurde es als Lebensmittel eingesetzt und bei der Behandlung von Mehl.
Kann Ihnen dienen: AlotropyAls Dünger und Conditioner von Pflanzenböden
Der Gips (Fall4· 2H2O) Es wurde seit den 18 als Dünger in Europa verwendet.
Kalzium muss für Anlagenwurzeln für eine angemessene Versorgung verfügbar sein. Dann verbessert die Zugabe von Kalzium den Gartenbau und Erdnusspflanzen (Erdnüsse).
Die Fäulnis von Erdnusswurzeln, die durch biologische Krankheitserreger sowie die apikale Fäulnis von Wassermelone und Tomate erzeugt werden, werden teilweise mit den landwirtschaftlichen Gipsanwendungen kontrolliert.
Der Gips hilft dabei. Durch die Reduzierung der auf dem Boden gebildeten Krusten erleichtert der Gips den Ausgang der Sämlinge. Es erhöht auch den Eintritt von Luft und Wasser in den Boden.
Der Gips hilft, den Boden zu verbessern, indem der Säure und die Toxizität von Aluminium gemildert werden, wodurch die Ernte für Natriumböden angepasst wird.
In der Herstellung anderer Verbindungen
Calciumsulfat reagiert mit Ammoniumbicarbonat, um Ammoniumsulfat zu bilden. Es wurde auch im Schwefelsäureproduktionsprozess verwendet.
Ashidro Calciumsulfat wird mit Schiefer oder Mager gemischt, und wenn die Mischung erhitzt wird, wird Schwefeltrioxid freigesetzt. Schwefeloxid ist ein Schwefelsäurevorläufer.