Kupfersulfat (CUSO4) Struktur, Eigenschaften, erhalten, verwendet, verwendet
- 3228
- 852
- Tizian Liebich
Er Kupfersulfat Es ist eine anorganische Verbindung, die durch Kupfer (Cu), Schwefel (S) und Sauerstoff (O) (O) (O) gebildet wird. Seine chemische Formel ist Cuso4. Das Kupfer befindet sich in einem Oxidationszustand +2, Schwefel +6 und Sauerstoff hat Valencia -2.
Es ist ein weißer Feststoff, der, wenn es der Luftfeuchtigkeit der Umwelt ausgesetzt ist4 •5H2ENTWEDER. Der weiße Feststoff wird durch Erhitzen des Blaues erhalten, um das Wasser zu beseitigen.
 Kupfersulfat (Cuo4) wasserfrei (ohne Wasser in seiner kristallinen Struktur). W. Oelen/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons.
Kupfersulfat (Cuo4) wasserfrei (ohne Wasser in seiner kristallinen Struktur). W. Oelen/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons. Es wird seit Jahrhunderten als antibakterielles Mittel eingesetzt, um Wunden beim Menschen und Tieren zu heilen. Es wirkt auch als Fungizid, als adstringierende, antidiarrheale und kontrollierende Darmkrankheiten bei Tieren. Es wird auch als Antihongos -Mittel in Pflanzen verwendet.
Einige ihrer Verwendungen wurden jedoch abgesetzt, weil ihr Überschuss sowohl für Menschen, Tiere als auch für Pflanzen giftig sein kann. Das Konzentrationsintervall, in dem es verwendet werden kann, ist eng und hängt von der Spezies ab.
Es wird als Katalysator bei chemischen Reaktionen und als Lösungsmittelentsrocknung verwendet. Es ermöglicht die Verbesserung des Widerstands und der Flexibilität einiger Polymere.
Übermäßige Mengen dieser Verbindung können für Böden schädlich sein, da sie für Mikroorganismen toxisch ist, die für Pflanzen vorteilhaft sind.
[TOC]
Struktur
Kupfersulfat wird durch ein Kupferion (Cu2+) und ein Sulfation (also42-).
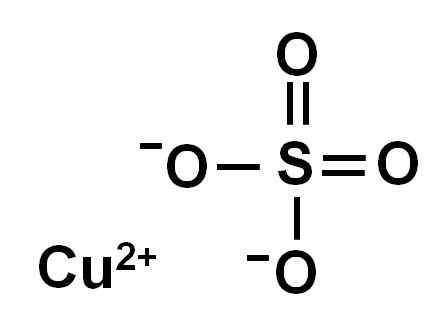 Ionica Kupfersulfat (II). Autor: Marilú Stea.
Ionica Kupfersulfat (II). Autor: Marilú Stea. Aufgrund des Verlustes von zwei Elektronen hat das Kupferion (II) die folgende elektronische Konformation:
1s2 2s2 2 p6 3s2 3p6 3d9
Es ist ersichtlich, dass das Orbital hat 3d unvollständig (hat 9 Elektronen statt 10).
Nomenklatur
- Wasserfreies Kupfersulfat
- Kupfersulfat (II)
- Cupric Sulfat
Eigenschaften
Körperlicher Status
Grünlich weißer Feststoff oder Kristall -verdrängt.
Molekulargewicht
159,61 g/mol
Schmelzpunkt
Bei 560 ° C bricht es zusammen.
Dichte
3,60 g/cm3
Löslichkeit
22 g/100 g Wasser bei 25 ° C. Unlöslich in Ethanol.
Chemische Eigenschaften
Wenn es der Feuchtigkeit der Luft unter 30 ° C ausgesetzt ist, wird es zur Cuso Pentahydrat -Verbindung4 •5H2ENTWEDER.
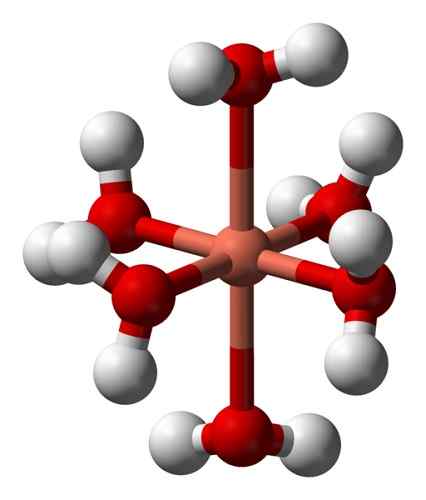
Seine wässrigen Lösungen sind blau aufgrund der Bildung des Hexaakuokobenion (ii) [Cu (H)2ENTWEDER)6]2+ das erzeugt eine solche Färbung. In diesem Ion sind zwei der Wassermoleküle weiter vom metallischen Atom entfernt als die anderen vier.
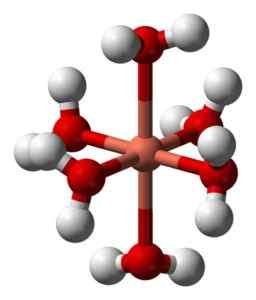 Deformierte Struktur der Hexaakuokobel -Ion (ii) [Cu (h)2ENTWEDER)6]2+. Benjah-BMM27 / Public Domain. Quelle: Wikimedia Commons.
Deformierte Struktur der Hexaakuokobel -Ion (ii) [Cu (h)2ENTWEDER)6]2+. Benjah-BMM27 / Public Domain. Quelle: Wikimedia Commons. Dies ist auf den sogenannten Jahn-Teller-Effekt zurückzuführen, der voraussagt, dass diese Art von Systemen die Verzerrung erlebt2+ Es hat eine elektronische Struktur, die in D endet9, das heißt ein unvollständiges Orbital (es wäre vollständig, wenn es d wäre10).
Kann Ihnen dienen: Calciumhydroxid (CA (OH) 2): Struktur, Eigenschaften, erhalten, verwendet, verwendetWenn Ammoniak hinzugefügt wird (NH3) Diese Lösungen werden gebildet, in denen der NH3 Wassermoleküle verdrängen nacheinander. Sie werden zum Beispiel aus [Cu (NH) gebildet3) (H2ENTWEDER)5]2+ Bis [Cu (NH3)4(H2ENTWEDER)2]2+.
Wenn der Cuso4 Es wird auf seine Zersetzung erhitzt.
Erhalten
Wasserdreizkupfersulfat kann durch völlige Dehydration der Pentahydratverbindung erhalten werden, die durch Erhitzen erreicht wird, bis die Wassermoleküle verdampfen.
Cuso4 •5H2O + Wärme → Cuo4 + 5 h2Oder ↑
Die Pentahydratverbindung ist blau, so dass das Cuso -Wasser beim Verlust des Kristallisationswassers erhalten wird4 Weiß wasserfrei.
Anwendungen
Einige seiner Verwendungen überlappen sich mit der der Pentahydratverbindung. Andere sind spezifisch für wasserfreie Substanz.
Als antibakterielles Mittel
Es hat Potenzial als antimikrobielles Mittel. Es wird seit Tausenden von Jahren auch in Kulturen Südamerikas und Mittelamerikas verwendet, um eine Wundinfektion durch Gaze zu verhindern, die in einer Lösung dieser Verbindung imprägniert sind.
Es wird geschätzt, dass im Mechanismus seiner antibakteriellen Aktivität die Ionen Cu2+ Sie bilden Chelate mit Enzymen, die für die zellulären Funktionen von Bakterien von entscheidender Bedeutung sind und sie deaktivieren. Sie induzieren auch die Bildung von Hydroxylradikalen OH •, die die Bakterienmembranen und ihre DNA beschädigen.
 Der Cuso4 Es kann gegen einige pathogene Bakterien wirken. Autor: Gerd Altmann. Quelle: Pixabay.
Der Cuso4 Es kann gegen einige pathogene Bakterien wirken. Autor: Gerd Altmann. Quelle: Pixabay. Vor kurzem wurde berichtet, dass Cuso Spuren4 Sie können die antimikrobielle Aktivität von Naturprodukten erhöhen, die reich an Polyphenolen sind, wie Granatenextrakten und Infusionen einiger Arten von Teepflanzen.
In Tierärzten
Es wird als antiseptisch und adstringierend für Schleimhautmembranen und zur Behandlung von äußerer Bindehautentzündungen und Otitis verwendet. Es dient dazu, therapeutische oder prophylaktische Bäder durchzuführen, um eine Fäulnis von Rindern, Schafen und anderen Säugetieren zu vermeiden.
 Cuo wässrige Lösungen4 Sie dienen dazu, Viehlöcher zu heilen. Autoren: Ingrid und Stefan Melichar. Quelle: Pixabay.
Cuo wässrige Lösungen4 Sie dienen dazu, Viehlöcher zu heilen. Autoren: Ingrid und Stefan Melichar. Quelle: Pixabay. Es dient als ätzendes Mittel für nekrotische Massen in den Extremitäten von Rindern, Stomatitisgeschwüren und granuliertem Gewebe dieser. Es wurde als Fungizid bei der Behandlung von Farbstoff und Krankheiten verwendet, die durch Hautpilze verursacht werden.
Es wird auch als Emético (Agent zum Provozieren von Erbrechen) bei Schweinen, Hunden und Katzen verwendet; als Antidiarrheal -Adstringent für Kälber und zur Kontrolle der Darmmoniliasis bei Geflügel- und Truthahntrichomoniasis.
Als Tierfuttermittelzusatz
Kupfersulfat wurde als Ergänzung in sehr kleinen Mengen für Fütterung von Rindern, Schweinen und Geflügel verwendet. Es dient zur Behandlung von Kupfermangel bei Wiederkäuern. Im Falle von Schweinen und Vögeln wird es als Wachstumsstimulans verwendet.
Kann Ihnen dienen: ChromatogrammKupfer wurde als wesentlich für die Biosynthese von Hämoglobin bei Säugetieren, kardiovaskuläre Struktur, Synthese des Knochenkollagens, Enzymsysteme und Fortpflanzung identifiziert.
Wie im vorherigen Abschnitt erwähnt, kann es auch als Medikamente für die Krankheitskontrolle geliefert werden. Ergänzungs- und/oder Medikamentenwerte müssen jedoch mit Pflege überwacht werden.
 Korralvögel und ihre Eier können durch ein überschüssiges Kupfersulfat in ihrer Ernährung beeinflusst werden. Autor: Pexels. Quelle: Pixabay.
Korralvögel und ihre Eier können durch ein überschüssiges Kupfersulfat in ihrer Ernährung beeinflusst werden. Autor: Pexels. Quelle: Pixabay. Aus einer bestimmten Menge, die von jeder Art abhängt, kann eine Verringerung des Wachstums, des Verlusts von Appetit und Gewicht, Schäden an bestimmten Organen und sogar der Tod von Tieren auftreten können.
Zum Beispiel verringert bei Hühnern die Supplementierung von 0,2% oder mehr die Aufnahme von Nahrungsmitteln mit dem daraus resultierenden Gewichtsverlust, verringertem Eierproduktion und der Dicke ihrer Schalen.
In landwirtschaftlichen Anwendungen
In organischen Produktionssystemen darf es nicht dürfen, synthetische Fungizide zu verwenden, nur Kupfer- und Schwefelprodukte werden akzeptiert, wie z. B. Kupfersulfat.
Zum Beispiel bestimmte Pilze, die Apfelpflanzen angreifen, wie z Venturia inaequalis, werden mit dieser Verbindung beseitigt. Es wird angenommen, dass möglicherweise die Ionen Cu2+ Sie sind in der Lage, die Pilzsporen zu betreten, Proteine denaturalisieren und mehrere Enzyme blockieren.
 Kupfersulfat dient dazu, einige Pilze zu bekämpfen, die Äpfel angreifen. Algirdas bei lt.Wikipedia / Public Domain. Quelle: Wikimedia Commons.
Kupfersulfat dient dazu, einige Pilze zu bekämpfen, die Äpfel angreifen. Algirdas bei lt.Wikipedia / Public Domain. Quelle: Wikimedia Commons. Bedeutung von Kupfer in Pflanzen
Das Kupferelement ist wichtig für physiologische Prozesse von Pflanzen wie Photosynthese, Atmung und Verteidigung gegen Antioxidantien. Sowohl der Mangel dieses Elements als auch sein Überschuss erzeugen reaktive sauerstoffhaltige Spezies, die für die Moleküle und Strukturen dieser schädlich sind.
Das Kupferkonzentrationsintervall für ein optimales Wachstum und die Entwicklung von Pflanzen ist sehr eng.
Nebenwirkungen auf die Landwirtschaft
Wenn dieses Produkt in landwirtschaftlichen Aktivitäten übermäßig eingesetzt wird, kann es phytotoxisch sein, eine vorzeitige Entwicklung von Früchten verursachen und seine Farbe verändern.
Darüber hinaus akkumuliert Kupfer am Boden und ist für Mikroorganismen und Regenwürmer giftig. Dies widerspricht dem Konzept der organischen Landwirtschaft.
 Obwohl der Cuso4 Es wird in der organischen Landwirtschaft verwendet, kann für Erdwürmer schädlich sein. Autor: Patricia Maine DeGrave. Quelle: Pixabay.
Obwohl der Cuso4 Es wird in der organischen Landwirtschaft verwendet, kann für Erdwürmer schädlich sein. Autor: Patricia Maine DeGrave. Quelle: Pixabay. Auf chemische Reaktionen
Der Cuso4 Wasserfrei dient als Katalysator für mehrere Reaktionen von Carbonyl -organischen Verbindungen mit Diolen oder ihren Epoxiden, die Dioxolane oder Acetoniden bilden. Dank dieser Verbindung können die Reaktionen unter weichen Bedingungen durchgeführt werden.
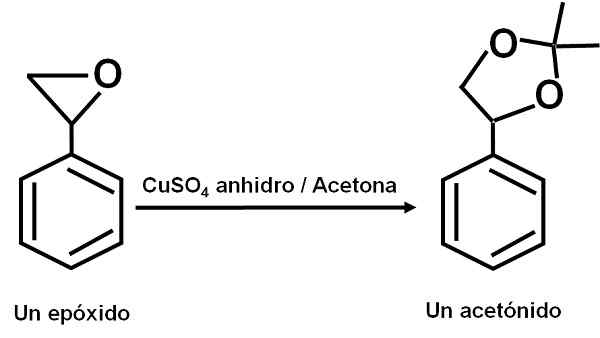 Beispiel für die Reaktion, bei der das Cuso4 wasserfreie wirkt als Katalysator. Autor: Marilú Stea.
Beispiel für die Reaktion, bei der das Cuso4 wasserfreie wirkt als Katalysator. Autor: Marilú Stea. Es wurde auch berichtet, dass seine katalytische Wirkung es ermöglicht, sekundäre, tertiäre, Benzyl- und alilische Alkohole zu seinen entsprechenden Olefinen zu dehydrieren. Die Reaktion erfolgt auf sehr einfache Weise.
Kann Ihnen dienen: AnetolReiner Alkohol wird zusammen mit dem Cuso erhitzt4 Bei einer Temperatur von 100-160 ° C für eine Zeit von 0,5-1,5 Stunden bei einer Temperatur von 100-160 ° C. Somit tritt Alkohol- und Olefin -Dehydration auf.
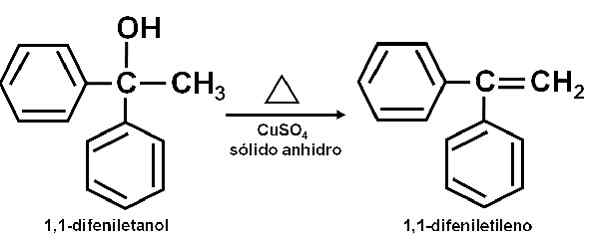 Dehydration eines Alkohols für Kupfersulfat (ii) wasserfrei. Autor: Marilú Stea.
Dehydration eines Alkohols für Kupfersulfat (ii) wasserfrei. Autor: Marilú Stea. Als Dehydrating Agent
Diese Verbindung wird in Chemielabors als Trockenmittel verwendet. Es dient dazu, organische Flüssigkeiten wie Lösungsmittel zu dehydrieren. Absorbieren Wasser, das die Cuo Pentahydratverbindung bildet4 •5H2ENTWEDER.
 Wenn der Cuso4 Weißanhydro absorbiert Wasser wird zur blauen Pentahydratverbindung4.5H2ENTWEDER. Crystal Titan/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons.
Wenn der Cuso4 Weißanhydro absorbiert Wasser wird zur blauen Pentahydratverbindung4.5H2ENTWEDER. Crystal Titan/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/4.0). Quelle: Wikimedia Commons. Polymere zu verbessern
Der Cuso4 Anhydro wurde verwendet, um die Eigenschaften bestimmter Polymere zu verbessern und gleichzeitig zu recycelbar zu sein.
Zum Beispiel wurden Partikel der Acetonverbindung mit Acrylnitril-Butadien-Gummi in einer speziellen Mühle gemischt, um Cuso-Partikel herzustellen4 Sei sehr klein.
Kupfersulfat verbessert die Polymer -Gewerkschaftspunkte, die eine Mischung mit hoher Resistenz, Härte und überraschender Flexibilität bilden.
In nicht detitierten therapeutischen Anwendungen
In der Vergangenheit wurden Kupfersulfatlösungen für das Magenwaschen verwendet, als jemand eine weiße Phosphorvergiftung erlitt. Die Lösung wurde jedoch sofort gerührt, um eine Kupfervergiftung zu vermeiden.
Die Lösungen dieser Verbindung wurden auch zusammen mit anderen Substanzen für topische Verbrennungen in der Haut durch Phosphor verwendet.
Manchmal dienten sie in bestimmten Formen der Ernährung.
Bestimmte Lotionen für Ekzeme, Impetigo und Intertrigo enthielten Cuo4. Lösungen wurden als adstringierend bei Augeninfektionen verwendet. Manchmal wurden die Kristalle direkt auf Verbrennungen oder Geschwüre aufgetragen.
Alle diese Anwendungen werden aufgrund der Toxizität, die überschüssige Verbindung induzieren kann.
Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Kupfersulfat. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Blei, d.R. (Herausgeber) (2003). CRC -Handbuch für Chemie und Physik. 85th CRC Press.
- Montag, J. et al. (2006). Eine In -vitro -Studie über Venturia inaequalis. J. Landwirtschaftlich. Food Chem. 2006, 54, 893-899. Link wiederhergestellt.Springer.com.
- Holloway, a.C. et al. (2011). Verbesserung der antimikrobiellen Aktivitäten des gesamten und subfraktionierten weißen Tees durch Sucht von Kupfer (II) Sulfat und Vitamin C gegen Staphylococcus aureus; Zum mechanistischen Ansatz. BMC Complement Alternal Med 11, 115 (2011). Abgerufen von BMCCOMPLEMENTMEDTHERAPIES.BiomedCentral.com.
- Sanz, a. et al. (2018). Kupferaufnahmemechanismus von Thalian arabidopsis COPT -Transporter mit hohem Feffinität. Protoplasma 256, 161-170 (2019). Link wiederhergestellt.Springer.com.
- Griminger, p. (1977). Wirkung von Kupfersulfat auf die Eierproduktion und die Schalendicke. Geflügelwissenschaft 56: 359-351, 1977. Von akademisch erholt.OUP.com.
- Hanzlik, r.P. Und Leinwetter, m. (1978). Reaktion von Epoxiden und Carbonylverbindungen durch wasserfreies Kupfersulfat. J. Org. Chem., Vol.43, nein.3, 1978. Aus Pubs geborgen.ACS.Org.
- Okonkwo, a.C. et al. (1979). Kupferbedarf von Babyschweinen, die gereinigte Diät gefüttert haben. The Journal of Nutrition, Band 109, Ausgabe 6, Juni 1979, Seiten 939-948. Von akademisch erholt.OUP.com.
- Hoffman, r.V. et al. (1979). Wasserfreies Kupfer (ii) Sulfat: eine Effizienz. J. Org. Chem., 1980, 45, 917-919. Aus Pubs geborgen.ACS.Org.
- Shao, c. et al. (2018). Verbesserte Zugfestigkeit von Acrylnitril-Butadien-Gummi/wasserfreiem Kupfersulfat-Verbundwerkstoffen, die durch Koordinationsvernetzung hergestellt wurden. Polym. Stier. 76, 1435-1452 (2019). Link wiederhergestellt.Springer.com.
- Betts, j.W. et al. (2018). Neuartige Antibakterien: Alternativen zu traditionellen Antibiotika. Kupfer. In Fortschritten in der mikrobiellen Physiologie. Von Scientedirect erholt.com
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Google -Websites. Wasserfreies Kupfersulfat machen. In der Paradox Home Chemie. Von Standorten geborgen.Google.com.
- « Regeln -T -Funktionen, damit es dient, Beispiele
- Konstantes (Programmier-) Konzept, Typen, Beispiele »

