Kupfersulfat -Pentahydratstruktur, Eigenschaften, verwendet

- 1579
- 250
- Joe Hartwig
Er Pentahydrat Kupfersulfat Es ist eine anorganische Verbindung, die durch Kupfer (Cu), Schwefel (S), Sauerstoff (O) und Wasser (H2ENTWEDER). Enthält Kupferionen (ii) (Cu2+) und Sulfat (also42-). Seine chemische Formel ist Cuso4 •5H2ENTWEDER.
In der Natur bildet es die Chalcantita oder den Calcant Mineral, auch Chalclasa oder Calclasa genannt. Es ist ein blauer kristalline Feststoff.
 Kupfersulfat Cuso Kupfersulfat4 •5H2ENTWEDER. Autor: überraschungsbilder. Quelle: Wikimedia Commons.
Kupfersulfat Cuso Kupfersulfat4 •5H2ENTWEDER. Autor: überraschungsbilder. Quelle: Wikimedia Commons. Es wird als Ernährungsergänzung für einige Tiere wie Wiederkäuer, Schweine und Geflügel verwendet. In der Landwirtschaft dient es als Pestizid. Bei Bergbauaktivitäten können andere Metalle wiederhergestellt werden.
Denn sein blauer Farbton dient für die Färbung von Stoffen und Metallen. Es wurde verwendet, um metallisches Kupfer auf Cellulosefasern abzuscheiden, um Strom leitfähige Stoffe zu erhalten. Es wird auch verwendet, um Kupfer -Nanopartikel und seine Oxide mit einer Vielzahl von Anwendungen vorzubereiten.
In hohen Konzentrationen kann es für Fauna und Flora giftig sein, daher wird es manchmal verwendet, um Schädlinge (Tiere oder Pflanzen) von Wasserumgebungen wie Lagunen und natürlichen Teichen zu beseitigen.
[TOC]
Struktur
Diese Verbindung wird durch das Kupferelement im Oxidationszustand +2 und im Sulfatanion gebildet. Letzteres hat ein Schwefelatom mit Valencia +6, umgeben von vier Sauerstoffatomen, jeweils mit Valencia -2. Auf diese Weise hat das Sulfation zwei negative Ladungen.
Es hat auch 5 Wassermoleküle in seiner Struktur. In der folgenden Abbildung können Sie sehen, wie die verschiedenen Atome im Glas angeordnet sind.
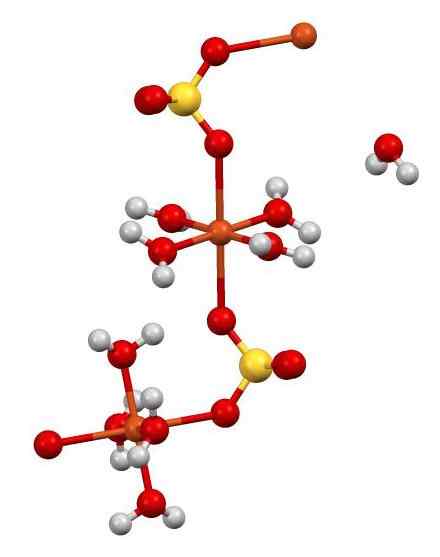 Cuo -Struktur4 •5H2ENTWEDER. Autor: Smokefoot. Quelle: Wikimedia Commons.
Cuo -Struktur4 •5H2ENTWEDER. Autor: Smokefoot. Quelle: Wikimedia Commons. Die Cu2+ (Orangenkugeln) wird gleichzeitig mit 4 -Stunden -Molekülen koordiniert2O (Sauerstoff = rot; Wasserstoff = weiß) und mit 2 Sauerstoffatomen der SOS42- (Schwefel = Gelb). In der Abbildung eins der H -Moleküle2O Es ist in offensichtlicher Freiheit, ist aber Teil der kristallinen Struktur.
Nomenklatur
 Mineral aus Chalcantita Cuso4 •5H2ENTWEDER. Autor: Archaeodontosaurus. Quelle: Wikimedia Commons.
Mineral aus Chalcantita Cuso4 •5H2ENTWEDER. Autor: Archaeodontosaurus. Quelle: Wikimedia Commons. - Pentahydrat Kupfersulfat
- Kupferleiden (ii) Pentahydrat
- Bluejack
- Blauer Stein (Englisch Blauer Stein)
- Chalcantita, Calcantita, Chalclasa oder Calclasa
Eigenschaften
Körperlicher Status
Blauer kristalline Feststoff.
Molekulargewicht
249.686 g/mol
Schmelzpunkt
Nach dem Erreichen von 110 ° C bricht es zusammen.
Dichte
2,286 g/cm3
Löslichkeit
Wasserlöslich: 22,0 g/100 g Wasser bei 25 ° C. Methanol löslich (wählen Sie3OH). Etwas löslich in Ethanol (wählen3CH2OH).
Chemische Eigenschaften
Diese Verbindung, wenn sie mit Wasser in Kontakt kommt, wird gelöst und bildet die Ionen Cu2+ Und so42-. Seine Löslichkeit im Wasser nimmt signifikant ab, wenn Schwefelsäure in Wasser vorhanden ist.
Es kann Ihnen dienen: kamphalter Alkohol: Struktur, Formel, Eigenschaften und VerwendungDie h2SW4 Bietet so Ionen42- Und seine Anwesenheit erzeugt die Wirkung von "gemeinsames Ion", da dieses Ion in Pentahydratkupfersulfat vorhanden ist. Die Auflösung kann wie folgt ausgedrückt werden:
Cuso4 •5H2Oder (fest) + Wasser ⇔ cu2+ + SW42- + Wasser
Daher, wenn das SO bereits in Lösung vorhanden ist42- von Schwefelsäure bewegt sich das Gleichgewicht nach links, dh zur Bildung des Feststoffs und somit nimmt die Löslichkeit ab.
Erhalten
Eine Möglichkeit, Pentahydratkupfersulfat zu erhalten2SW4) bei kontrollierter Temperatur. Die Malquita enthält Cu2(OH)2CO3 Mit anderen Verunreinigungen wie Eisen.
Die unreine Lösung von Kupfer (II) wird mit Wasserstoffperoxid (H) behandelt2ENTWEDER2) um sicherzustellen, dass Eisenverunreinigungen (ii) (Glaube2+) Eisen werden (iii) (Glaube3+). Letzteres wird in Form eines Eisenhydroxids hergestellt (Faith (OH)3) unter Verwendung von Natriumhydroxid (NaOH).
Niederschlag bedeutet, dass Teilchen eines unlöslichen Feststoffs in der Lösung gebildet werden, die auf den Boden des Behälters fällt, der sie enthält.
 Aussehen einer konzentrierten Cuso -Lösung4 •5H2ENTWEDER. Autor: Public Domainpartures. Quelle: Pixabay.
Aussehen einer konzentrierten Cuso -Lösung4 •5H2ENTWEDER. Autor: Public Domainpartures. Quelle: Pixabay. Die resultierende Mischung wird gefiltert, um den Feststoff des Glaubens zu entfernen (OH)3 Und die verbleibende Flüssigkeit wird mit Ethanol behandelt (C2H5OH), Methanol (wählen Sie3OH) oder Schwefelsäure, um alle Ionen Cu auszurüsten2+ Cuo4 •5H2ENTWEDER.
Wenn Ethanol zum Beispiel hinzugefügt wird, gibt es für Cu -Ionen weniger Wasser zur Verfügung2+ Und so42- sind in Lösung und tendieren dazu, sich zusammenzuschließen. Wirkt als dehydrierend. Je mehr Ethanol es solide hinzugefügt wird.
Der ausgefällte Feststoff kann reduziert werden, um ihn zu reinigen. Dazu löst es in Wasser bei einer Temperatur von 80 bis 90 ° C und dann kühlt die Lösung bei 25-30 ° C ab. Die Pentahydratverbindung eilt erneut und die Verunreinigungen bleiben in Lösung.
Anwendungen
Hat ein breites Intervall an kommerziellen Anwendungen.
Im Bereich der Landwirtschaft dient es als Pestizid, Insektizid, Herbizid, Fungizid, Keimmittel und Bodenzusatz. Bei Tiermintischen, Fungizid und Emético (um Erbrechen zu verursachen) wird es als Antihelmintikum verwendet).
Es wird in Farbstoffen und Farbstoffen als blaues oder grünes Pigment verwendet, als ein Unterricht in der Farbe von Stoffen und Metallen. Auch als Impression Toner in Fotografien und als Reagenz zur Intensivierung der Negative.
Kann Ihnen dienen: Effektive nukleare BelastungEs wird in Bergbauaktivitäten als Flotationsreagenz für Zink und Bleiwiederherstellung verwendet. Es dient dazu, andere Kupferverbindungen herzustellen, es wird in der Tan verwendet.
In Nahrung für Tiere
Diese Verbindung wird in der Ernährung von Schweinen in sehr kleinen Mengen als Wachstumspromotor verwendet, insbesondere in der hinteren Phase. Der Mechanismus, durch den er diesen Effekt hat, ist noch unbekannt.
Einige Forscher behaupten, dass es die Population pathogener oder schädlicher Bakterien im Darm von Tieren verringert und folglich ihr Wachstum begünstigt.
 Mit dem Cuso4 •5H2O Sie können die Entwicklung von entwöhnten Schweinen bevorzugen. Autor: Mabelamber. Quelle: Pixabay.
Mit dem Cuso4 •5H2O Sie können die Entwicklung von entwöhnten Schweinen bevorzugen. Autor: Mabelamber. Quelle: Pixabay. Andere Wissenschaftler zeigen, dass es die Gesundheit des Darms dieser Tiere verbessert, aber bestimmte Untersuchungen deuten darauf hin, dass die intravenöse Kupferinjektion auch ihr Wachstum verbessert.
Es wurde auch für den gleichen Zweck im Geflügel verwendet und im Kupfermangel von Wiederkäuern verwendet.
In der Nanopartikelsynthese
Pentahydrat -Kupfersulfat wurde verwendet, um gemischte Kupfer -Nanopartikel und Kupferoxid (i) (Cu/Cu) zu erhalten2ENTWEDER).
Nanopartikel sind extrem kleine Strukturen, die nur durch ein elektronisches Mikroskop zu sehen sind.
Cu/Cu -Staub2O In Form von Nanopartikeln, die es in der Katalyse oder Beschleunigung chemischer Reaktionen, bei Halbleitern und in antimikrobiellen Materialien verwendet hat, unter anderen Anwendungen.
In Studien zur Schädlingsbekämpfung
Der Cuso4 •5H2Oder es wurde in Erfahrungen verwendet, um seine Toxizität gegenüber den Schnecken der Art zu bewerten Pomacea Canaliculata.
Dies sind einheimische Mollusken der tropischen Regionen Südamerikas, die in verschiedenen Arten von Ökosystemen leben, von Sümpfen und Lagunen bis zu Seen und Flüssen.
Sie werden untersucht, weil einige menschliche Parasiten wie die veranstalten Schistosoma Mansoni (Trematode, der die Krankheit von Bilharzia erzeugt). Carakolen können auch für landwirtschaftliche Pflanzen von überfluteten Regionen schädlich sein.
 Caparazone de Los Caracoles Pomacea Canaliculata. H. Zell/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons.
Caparazone de Los Caracoles Pomacea Canaliculata. H. Zell/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons.  Eier, die von den Schnecken in einer Wasserpflanze abgelagert werden. Diese Schnecken bilden manchmal eine Pest, die mit dem Cuso kontrolliert werden kann4 •5H2ENTWEDER. Shan LV, Nationales Institut für parasitäre Erkrankungen/CC von (https: // creativecommons.Org/lizenzen/by/2.5). Quelle: Wikimedia Commons.
Eier, die von den Schnecken in einer Wasserpflanze abgelagert werden. Diese Schnecken bilden manchmal eine Pest, die mit dem Cuso kontrolliert werden kann4 •5H2ENTWEDER. Shan LV, Nationales Institut für parasitäre Erkrankungen/CC von (https: // creativecommons.Org/lizenzen/by/2.5). Quelle: Wikimedia Commons. Laut den untersuchten Studien sind wässrige Pentahydrat -Kupfersulfatlösungen für diese Schnecken äußerst giftig, sodass diese Verbindung verwendet werden kann, um Mollusk aus befallenen Gebieten zu beseitigen.
Kann Ihnen dienen: VerbrennungsreaktionenNach bestimmten Untersuchungen liegt dies daran, dass die Schnecke nicht für das Kupferion benötigt wird, so dass nur der Kontakt mit diesem Ion ausreicht, damit der Tod des Tieres auftritt.
In Strom leitfähigen Stoffen
Diese Verbindung wurde verwendet, um Textilmaterial mit integrierten Stromsensoren zu erhalten. Diese Art von Stoff hat Anwendung in Stromspeichergeräten, Drucksensoren, Fotodetektor und leichten Ausstellungsbildschirmen.
Um Strom leitfähige Stoffe zu erhalten, ist eine Metallfaser aus gewebten Cellulose -Cellulose namens "Lyocell" mit metallischem Kupfer bedeckt. Die Beschichtung wird auf nicht -elektrolytische Weise auf der Grundlage einer Lösung von CUSO4 • 5H2O und anderen Hilfsschemen durchgeführt.
 Lyocell Faser. Diese Art von Stoff wurde in Kupferbeschichtungstests verwendet. DobrozHinetsky/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons.
Lyocell Faser. Diese Art von Stoff wurde in Kupferbeschichtungstests verwendet. DobrozHinetsky/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons. Der auf diese Weise erhaltene Gewebe kann ein elektrisches Signal auch unter Verformungsbedingungen oder Dehnung übertragen, wobei eine hohe Leitfähigkeit aufrechterhalten wird.
Auswirkungen auf die Umwelt
Wie oben der Cuso erläutert4 •5H2Oder beim Auflösen in Wasser erzeugt das Kupferion (ii).
Obwohl Kupfer in geringen Konzentrationen für zelluläre Aktivitäten lebender Organismen von wesentlicher Bedeutung ist, kann es in hohen Konzentrationen toxisch sein und sogar zum Tod führen.
Daher ist das Vorhandensein dieses Ions in der Umwelt ein Risiko für Tiere und Pflanzen. In aquatischen Ökosystemen kann es in Lebewesen und in der Nahrungskette bioakumuliert werden, was Schäden verursacht.
 Der Cuso4 •5H2O Es kann für Wasserumgebungen schädlich sein. Autor: JamesDemers. Quelle: Pixabay.
Der Cuso4 •5H2O Es kann für Wasserumgebungen schädlich sein. Autor: JamesDemers. Quelle: Pixabay. In bestimmten Erfahrungen wurde festgestellt, dass die Kontamination von Wasserumgebungen mit Pentahydrat -Kupfersulfat bewirkt.
Das bedeutet, dass Pflanzen in Vorhandensein dieses Salzes in hohen Konzentrationen weniger wachsen.
Verweise
- Blei, d.R. (Herausgeber) (2003). CRC -Handbuch für Chemie und Physik. 85th CRC Press.
- Kokes, h. et al. (2014). Auflösung von Kupfer und Eisen aus Malachiterz und Präzision von Kupfersulfat -Pentahydrat durch chemische Prozesse. Ingenieurwissenschaft und -technologie, ein internationales Journal. 2014; 17 (1): 39-44. Von Scientedirect erholt.com.
- Azevedo B Alves., J.P. und peixoto, m.N. (2015). Biomasse Reduktion von Nerviger Salvinien Kupfersulfat -Pentahydrat ausgesetzt (Cuo4.5H2ENTWEDER). Rev. Umgebungs. Wasser 2015; 10 (3): 520-529. Von doaj geborgen.Org.
- Wurzel, w. et al. (2019). Flexibler Textil-Dehnungssensor auf Basi. Polymers 2019, 11, 784. MDPI erholt sich.com.
- Pitelli, r.ZU. et al. (2008). Akute Toxizität von Kupfersulfat und wässrigem Extrakt von getrockneten Neemblättern auf Schnecken (Pomacea Canaliculata). SCI ACT. Biol. Sci. 2008; 30 (2): 179-184. Von doaj geborgen.Org.
- Badawy, s.M. et al. (2015). Synthese, Charakterisierung und katalytische Aktivität von Cu/Cu2O -Nanopartikeln, die in wässriges Medium hergestellt wurden. Bulletin des chemischen Reaktionstechnik und Katalyse. 2015; 10 (2): 169-174. Von doaj geborgen.Org.
- Justel, f.J. et al. (2014). Löslichkeiten und physikalische Eigenschaften gesättigter Lösungen im Kupfersulfat + Schwefelsäure + Meerwassersystem bei verschiedenen Temperaturen. Brasilianisches Journal of Chemical Engineering. 2015; 32 (3): 629-635. Von doaj geborgen.Org.
- Park, c.S. und Kim, b.G. (2016). In vitro Löslichkeit von Kupfer (II) Sulfat und Dicopperchlorid -Trihydroxid für Schweine. Asiatische Austalas. J. Anim. Sci. 2016; 29 (11): 1608-1615. Von doaj geborgen.Org.
- ODER.S. Nationalbibliothek für Medizin. (2019). Kupfersulfat -Pentahydrat. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Wikipedia (2020). Chalantthit. Abgerufen von.Wikipedia.Org.
- « Marine Biomas -Eigenschaften, Typen, Flora, Fauna
- Wachse (biologische) Struktur, Eigenschaften, Funktion, Typen »

