Mangansulfat (MNSO4) Struktur, Eigenschaften, erhalten, verwendet, verwendet

- 1303
- 109
- René Riediger
Er Mangansulfat (II) Es ist ein anorganischer Feststoff, der von den Manganelementen (Mn), Schwefel (S) und Sauerstoff (O) gebildet wird. Seine chemische Formel ist MSO4. Seine wasserfreie Form (ohne Wasser in seiner Struktur) ist ein weißer Feststoff. Es hat jedoch mehrere hydratisierte Formen und alle sind rosa Feststoffe.
Mangansulfat in sehr kleinen (winzigen) Mengen wird sowohl für Tiere als auch für Menschen als Mikronährstoff verwendet, da es für die normale Funktion des Organismus erforderlich ist.
 Mangansulfat Anhidro Mnso4. YOSF0113 bei English Wikipedia / Public Domain. Quelle: Wikimedia Commons.
Mangansulfat Anhidro Mnso4. YOSF0113 bei English Wikipedia / Public Domain. Quelle: Wikimedia Commons. Es wird auch mit bestimmten Düngemitteln in mangelhaften Böden auf Mangan (MN) für landwirtschaftliche Pflanzen, die es brauchen.
Aufgrund der rosa Färbung seiner hydratisierten Sorten wird es in Pigmenten verwendet, die dazu dienen, Keramik, Malvorlagen und andere Materialien zu malen. Es dient auch dazu, andere Manganverbindungen zu erhalten.
Die Mons4 muss sorgfältig manipuliert werden. Die Inhalation kann Atemprobleme verursachen und schwerwiegende Unannehmlichkeiten im Nervensystem verursachen, einschließlich Symptome, die der Parkinson -Krankheit ähneln.
Sein Überschuss kann auch Land und Wassertiere und Pflanzen beschädigen.
[TOC]
Struktur
Wasserfreies Mangansulfat (ohne Wasser in seiner kristallinen Struktur) wird durch ein Manganionen in Oxidation +2 gebildet, dh MN2+ und ein Sulfatanion so42-.
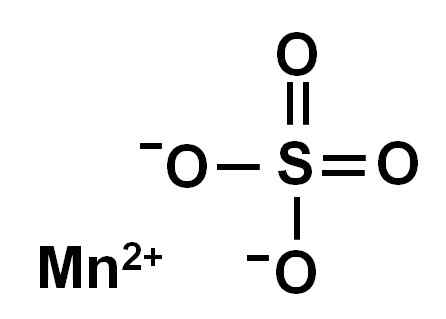 Chemische Struktur von Mangansulfat4. Autor: Marilú Stea.
Chemische Struktur von Mangansulfat4. Autor: Marilú Stea. Nomenklatur
- Mangansulfat (II)
- Manganmonosulfat
- Mangansulfat Anhidro Mnso4
- Mangan -Mangan -Sulfat MSSO4 •H2ENTWEDER
- Tetrahydrat -Mangan -Sulfat MSO4 •4H2ENTWEDER
- Mangansulfat Pentahydrat4 •5H2ENTWEDER
- Hepthydrated Mangansulfat4 •7h2ENTWEDER
Eigenschaften
Körperlicher Status
Die Mons4 wasserfrei (ohne Wasser in seiner Struktur) ist ein kristalliner weißer Feststoff. Hydratisierte Sorten sind jedoch rosa oder hellrote Feststoffe.
 Manganeso Sulfat Tetrahydrat MnSO4.4H2Oder ist ein rosa Feststoff. Benjah-BMM27 / Public Domain. Quelle: Wikimedia Commons.
Manganeso Sulfat Tetrahydrat MnSO4.4H2Oder ist ein rosa Feststoff. Benjah-BMM27 / Public Domain. Quelle: Wikimedia Commons. Molekulargewicht
MSSO4 = 151 g/mol
MSSO4 •H2O = 169,02 g/mol
Schmelzpunkt
Wasserfreies MSSO4 = 700 ºC
Monohydrat MSO4 •H2O = 400-450 ° C
Menso Tetrahydrat4 •4H2O = 30 ° C
Siedepunkt
Wasserfreies MSSO4 = Es zersetzt sich bei 850 ºC.
Es kann Ihnen dienen: Kobaltchlorid (COCL2 (: Struktur, Nomenklatur, EigenschaftenMenso Tetrahydrat4 •4H2O = 850 ° C
Dichte
MSSO4 = 3,25 g/cm3
MSSO4 •H2O = 2,95 g/cm3
Löslichkeit
Sehr löslich in Wasser: 52 g/100 ml Wasser bei 5 ° C. Alkohollöslich. Unlöslich in Äther. Leicht löslich in Methanol.
pH
Eine Monse -Lösung4 •H2Oder 5% haben einen pH -Wert von 3,7.
Chemische Eigenschaften
Beim Auflösen in Wasser wird der MNSO4 in seine Mn -Ionen unterteilt2+ Und so42-.
Das Manganion (ii) mn2+ In Säure oder neutraler Lösung ist es mit 6 Wassermolekülen verbunden2Oder die hexaakuomanganische Ion [Mn (h) bilden2ENTWEDER)6]2+, Welches ist rosa.
Das hexaakuomanganische Ion [Mn (h)2ENTWEDER)6]2+ Es ist ziemlich resistent gegen Oxidation. In Basismedium (alkalischem pH) wird dieses Ion zu Manganhydroxid (ii) Mn (OH)2, Dies ist leicht oxidiert, bildet Manganverbindungen (III) und Mangan (iv).
 MSSO -Lösungen4 Säuren sind durch das Vorhandensein des Hexaakuomangan -Ions rosa [Mn (H)2ENTWEDER)6]2+. Autor: Steve Cross. Quelle: Pixabay.Mangansulfat hat mehrere hydratisierte Formen, dh mit Wasser H2Oder in seiner kristallinen Struktur.
MSSO -Lösungen4 Säuren sind durch das Vorhandensein des Hexaakuomangan -Ions rosa [Mn (H)2ENTWEDER)6]2+. Autor: Steve Cross. Quelle: Pixabay.Mangansulfat hat mehrere hydratisierte Formen, dh mit Wasser H2Oder in seiner kristallinen Struktur.
Dies sind Monohydrat -MSO4 •H2Oder Tetrahydrate MSO4 •4H2Oder Mnse Pentahydrate4 •5H2O und Hepthydrat MSO4 •7h2ENTWEDER. Diese hydratisierten Formen enthalten das hexaakuomanganische Ion [Mn (H)2ENTWEDER)6]2+ In ihren Kristallen und aus diesem Grund sind sie rosa Feststoffe.
Der Monohydrat -Mensoo4 •H2Oder es ist leicht aus dem Ausblühen, was bedeutet, dass es langsam einen Teil seines Hydratationswassers verliert, wenn es der Umwelt ausgesetzt ist.
Erhalten
Die Mons4 Kann durch Behandlung von Manganoxid (II) MNO, MN Manghanous Hydroxid (OH) erhalten werden2 o Mangancarbonat (ii) MNCO3 Mit Schwefelsäure H2SW4.
Mnco3 + H2SW4 → MSSO4 + H2Oder + co2
Anwendungen
Als Ernährungsergänzung
Mangansulfat in winzigen Mengen dient bestimmten Funktionen des menschlichen Körpers und der Tiere.
Deshalb ist es als nützliche Verbindung in der Ernährung wichtig und wird als Nahrungsergänzung geliefert. Es wird in Spuren verwendet (extrem kleine Mengen).
Hohe Mengen können sehr giftig und schädlich sein.
In Veterinärmedizin
Die Mons4 Korralvögel (Hühner, Truthähne, Enten und Phaisanes) werden verabreicht, um den Mangel oder den Mangel an Manganelement bei diesen Tieren zu verhindern.
Kann Ihnen dienen: Kaliumjodat (KIO3)Manganmangel manifestiert sich beispielsweise als Perosis, die die Verformung der Knochen junger Vogelbeine ist.
 Patitos benötigen möglicherweise Monste -Spuren4 In seiner Ernährung, um Perose zu verhindern. Autoren: s. Hermann & F. Richter. Quelle: Pixabay.
Patitos benötigen möglicherweise Monste -Spuren4 In seiner Ernährung, um Perose zu verhindern. Autoren: s. Hermann & F. Richter. Quelle: Pixabay. Es gilt für die Fütterung dieser Vögel in sehr kleinen Mengen oder Spuren.
In der Landwirtschaft
Mangansulfat wird als Mikronährstoff in Düngemitteln für Reben (Traubenpflanzen) und Tabakplantagen in mangelhaften Leitern auf Mangan verwendet.
Einige Studien zeigen jedoch, dass überschüssiges Manganulfat die Bildung bestimmter wichtiger Enzyme für das Wachstum von Pflanzen und ihre Ausbrüche hemmen oder verringern kann.
 In einigen Fällen wird MnSO angewendet4 auf den Boden, wo Traubenpflanzen sind. Autor: Schwoaze. Quelle: Pixabay.
In einigen Fällen wird MnSO angewendet4 auf den Boden, wo Traubenpflanzen sind. Autor: Schwoaze. Quelle: Pixabay. Zum Beispiel wurde festgestellt, dass es für einige Pflanzen wie Baumwolle giftig ist.
Die Mons4 Es wird auch in Fungiziden verwendet und ist zusammen mit bestimmten organischen Verbindungen Teil bestimmter Pestizide.
In mehreren Anwendungen
Die Mons4 Hydratisiert wird durch seine Färbung verwendet, um anorganische Pigmente vorzubereiten, die in roten Lack für Keramik, in Stoffen und anderen Materialfarben verwendet werden.
Mangansulfat wird in der Glasherstellung verwendet und Seifen werden auch damit zubereitet.
 Einige Keramikfliesen können Mangansulfatpigmente enthalten. Autor: Dwilliams. Quelle: Pixabay.
Einige Keramikfliesen können Mangansulfatpigmente enthalten. Autor: Dwilliams. Quelle: Pixabay. Die Mons4 Es ist das Ausgangsmaterial, um das Manganmetall (MN) elektrolytisch zu erhalten, dh durch das Auftragen von Strom auf wässrige Lösungen.
Es ermöglicht Ihnen auch, Mangandioxid zu erhalten2 und Mangancarbonat3.
Die Mons4 Es wird auch für die chemische Analyse und die Formulierung von Lösungen verwendet, die in Genetikversuche mit Mikroorganismen verwendet werden.
Risiken
Mangansulfat enthält das Manganion (ii) (mn2+), die je nach Mengen, zu denen die Person, das Tier oder die Pflanze ausgesetzt sind, sowohl harmlos als auch giftig sein kann.
Mangan ist wichtig für das normale Funktionieren des Organismus von Menschen, Tieren und einigen Pflanzen. Leider ist Mangan auch neurotoxisch, dh es beeinflusst das Nervensystem und einige Pflanzenfunktionen.
Kann Ihnen dienen: Wer hat das erste moderne Thermometer entworfen?Scheinbar sichere Mengen
Die Mons4 Verabreicht mit Lebensmitteln mit geformtem Essen (extrem kleine oder winzige Mengen) ist im Allgemeinen durch Lebensmittel- und Medikamentenverabreichung oder FDA (Akronym für Englisch Food and Drug Administration).
Gefährliche Beträge
Eine längere oder wiederholte Exposition dieser Verbindung in nennenswerten Mengen kann dem menschlichen und tieren Schaden zufügen.
Es erzeugt Reizungen in den Schleimhaut und Schleimhäuten des Atemwegs, der Anorexie, des Kopfschmerzes, des Gleichgewichts, der Lungenentzündung und der Atemwegsinfektionen.
Chronischer Inhalation verursacht Schäden am Nervensystem, erzeugt Manghanismus, Zittern in den typischen Händen und Symptomen der Parkinson -Krankheit.
 Mangansulfat beeinflusst das Nervensystem. Autor: Sabine Zierer. Quelle: Pixabay.
Mangansulfat beeinflusst das Nervensystem. Autor: Sabine Zierer. Quelle: Pixabay. Daher sollte die Dispersion von MSO -Staub vermieden werden4, Verwenden Sie Atemgeräte und Schutzhandschuhe.
Es ist giftig für das Leben im Wasser und erzeugt in diesem Fall langfristige Auswirkungen. Es muss an Orten gespeichert werden. Es ist sehr wichtig, dass es nicht in der Umwelt verworfen werden kann.
Verweise
- ODER.S. Nationalbibliothek für Medizin. (2019). Sulfat -Mangan. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Ullmanns Enzyklopädie der industriellen Chemie. (1990). FÜNFTE AUSGABE. Band A22. VCH Verlagsgellschaft MBH.
- ODER.S. Nationalbibliothek für Medizin. (2019). Manganulfatmonohydrat. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Dunham, m.J. (2010). Leitfaden zur Yast -Genetik: Funktionelle Genomik, Proteomik und andere Systemanalyse. Mittelformulierung. In Methoden in der Enzymologie. Von Scientedirect erholt.com.
- Saric, m. und Lucchini, r. (2007). Mangan. Sie nutzen. In Handbook über die Toxikologie der Metalle (dritte Ausgabe). Von Scientedirect erholt.com.
- Vallero, d. (2014). Neurologische Wirkungen von Luftpolutanten. Mangan. In Fonds of Air Pollution (fünfte Ausgabe). Von Scientedirect erholt.com.
- Jubeln. (1986). In vitro Kultur von Vitis: Die Auswirkungen von Lichtspektrum -Manganulfat und Kaliumiodid auf die Morphogenese. Pflanzenzelle, Gewebe und Organkult 7: 121-134 (1986). Link wiederhergestellt.Springer.com.
- « Secbutil -Struktur, Merkmale, Nomenklatur, Ausbildung
- +125 kurze und beliebte Sprüche [mit Bedeutung] »

