Natriumsulfat (Na2SO4) -Struktur, Eigenschaften, Verwendungen, erhalten

- 2575
- 524
- Jasmine Kupprion
Er Natriumsulfat Es ist ein anorganisches Salz, dessen chemische Formel na ist2SW4. Es besteht aus einem weißen Feststoff, der in drei Formen vorhanden ist: wasserfrei, Heptohydrat (von wenig Existenz) und Decayroper (das als Glaubert -Salz bekannt ist); Letzteres ist die am häufigsten vorkommende Form von Natriumsulfat.
Natriumsulfat Decayroyed, Na2SW4· 10H2Oder es wurde 1625 von Glaubert im Wasser einer Feder entdeckt, der es aufgrund seiner medizinischen Eigenschaften zum Salzabilis (wundersames Salz) ernannte.
 Taktglas mit einer Natriumsulfatprobe. Quelle: Walkerma über Wikipedia.
Taktglas mit einer Natriumsulfatprobe. Quelle: Walkerma über Wikipedia. Natriumsulfat hat zahlreiche Anwendungen in der Textil- und Papierindustrie sowie in der Glasherstellung. Die Verwendungen werden mit thermischen Anwendungen erweitert, darunter die Umweltversorgung von Wärme und Kühlung von Laptops.
Natriumsulfat ist eine Verbindung mit geringer Toxizität und ihre schädlichen Wirkungen. Sie sind grundsätzlich mechanisch und nicht chemisch. Aus kristallographischen Gründen dieses Salz, wie sein Poetium -Gegenstück, k2SW4, präsentiert Gerüst und polymorphe Strukturen.
[TOC]
Struktur
Wasserfreies Salz
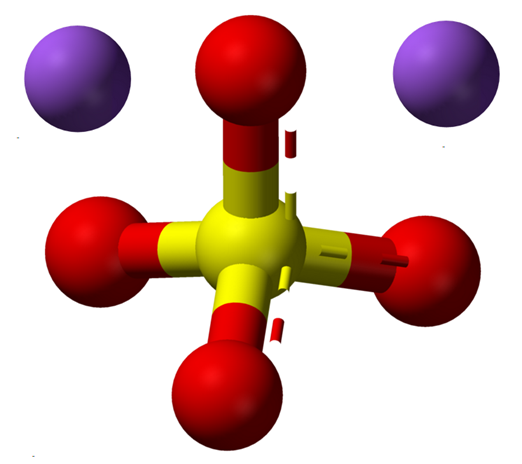 Wasserfreie Natriumsulfationen. Quelle: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Wasserfreie Natriumsulfationen. Quelle: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Die NA -Formel2SW4 Zeigt einmal an+ Und so42- Sie sind in einer 1: 2 -Beziehung; Das heißt für jeweils zwei Kationen na+ Es gibt so ein Anion42- mit ihnen durch elektrostatische Anziehung interagieren (überlegenes Bild).
Dies gilt natürlich für die NA2SW4 wasserfrei, ohne Wassermoleküle, die mit Natrium in den Kristallen koordiniert werden.
 Natriumsulfat
Natriumsulfat Obwohl es ein einfaches Erscheinungsbild ist, ist seine Beschreibung strukturell komplex. Dann ein2SW4 Es präsentiert Polymorphismus mit bis zu fünf kristallinen Phasen: I, II, III, IV und V, deren Übergangstemperaturen 180, 200, 228, 235 bzw. 883 ° C beträgt.
Obwohl es keine Referenzen gibt, die es zertifizieren, die NA2SW4Ich muss diejenige sein, die eine hexagonale kristalline Struktur hat, die dichter ist als die nationale ortorrombische2SW4Iii, in dessen Kristalle die Na+ Tetraeder Form (Nao4) und Oktaedros (Nao6) Koordination; Das heißt, es kann von vier oder sechs Anionen umgeben sein42-.
Decayedratada Salz
Inzwischen die monokline kristalline Struktur ihres wichtigsten Hydrats NA2SW4· 10H2Oder es ist einfacher. Darin sind es praktisch die Wassermoleküle, die mit dem Na interagieren oder koordinieren+ In der Oktaedra NA (h2ENTWEDER)6+, Mit dem SO42- kaum eine ausreichende Stabilität des Glass beizutragen, um in einer soliden Phase zu existieren.
Es kann Ihnen dienen: Erste ChemierevolutionSein Schmelzpunkt (32,38 ºC) ist jedoch viel niedriger als der von wasserfreiem Salz (884 ºC)2SW4.
Eigenschaften
Namen
-Natriumsulfat (IUPAC)
-Glauber Salz (Dehydrat)
-Sala Miraculous (Decayroper)
-Dinatriumsulfat.
Molmasse
142.04 g/mol (anh¡dro)
322,20 g/mol (DeChydrate)
Aussehen
Weißer hygroskopischer kristalline Feststoff
Geruch
Toilette
Geschmack
Bitter und salzhaltig
Dichte
2.664 g/cm3 (wasserfrei)
1,464 g/cm3 (Dahydrate)
Beachten Sie, wie Wassermoleküle innerhalb der Kristalle dazu führen.
Schmelzpunkt
884 ºC (wasserfrei)
32,38 ºC (DeChydrate)
Siedepunkt
1.429 ºC (wasserfrei)
Wasserlöslichkeit
4,76 g/100 ml (0 ºC)
13,9 g/100 ml (20 ºC)
42,7 g/100 ml (100 ºC)
Alle Löslichkeitswerte entsprechen wasserfreiem Salz, der bei allen Temperaturen in Wasser ziemlich löslich ist.
Die Löslichkeit steigt abrupt zwischen 0 ° C und 38,34 ° C an und beobachtet, dass in diesem Bereich der Temperaturen die Löslichkeit mehr als das 10 -fache zunimmt. Die Löslichkeit von 32,38 ° C ist jedoch unabhängig von der Temperatur.
Es kommt vor, dass sich bei Temperatur 32,8 ° C das Dekayedrat -Natriumsulfat in seinem eigenen kristallinen Wasser löst. Daher ein Gleichgewicht zwischen Decayydratsalz, Anhydra -Salz und der gesättigten Lösung von Natriumsulfat.
Solange der dreiphasige Zustand beibehalten wird, bleibt die Temperatur konstant, wodurch die Temperatur der Thermometer kalibriert wird.
Andererseits sind die Lösungen für Heptahydratsalz:
19,5 g/100 ml (0 ºC)
44,0 g/100 ml (20 ºC)
Beachten Sie, dass das Heptahydrat -Salz bei 20 ° C dreimal löslicher ist als wasserfreier.
Brechungsindex
1.468 (wasserfrei)
1,394 (DeChydrate)
Stabilität
Stabil unter empfohlenen Lagerbedingungen. Unvereinbar mit starken Säuren und Basen, Aluminium und Magnesium.
Zersetzung
Wenn es zur Zersetzung erhitzt wird, emittiert es einen giftigen Rauch von Schwefeloxid und Natriumoxid.
pH
Eine 5 % ige wässrige Lösung hat einen pH -Wert von 7.
Reaktivität
Natriumsulfat dissoziiert in wässriger Lösung in 2 na+ Und so42-, Dadurch kann das Sulfation mit dem BA kombiniert werden2+ Bariumsulfat ausfällt. Es hilft praktisch, die Bariumionen von Wasserproben zu bewegen.
Kann Ihnen dienen: TransaminierungNatriumsulfat wird durch Reaktion bei hohen Temperaturen mit Kohle Natriumsulfid:
N / A2SW4 + 2 C => na2S +2 co2
Glbauberts Salz, Naso4.10H2O reagiert mit Kaliumcarbonat, um Natriumcarbonat zu produzieren.
Anwendungen
Papierindustrie
Natriumsulfat wird bei der Herstellung von Papierzellstoff verwendet. Es wird bei der Ausarbeitung von Kraftpapier verwendet, das nicht Lignin enthält oder sich dem Bleichprozess unterwirft, der ihm einen großen Widerstand liefert. Darüber hinaus wird es in der Kartonherstellung verwendet.
Reinigungsmittel
Es wird als synthetisches Waschmittelfüllmaterial für die Verwendung zu Hause verwendet, was zum Waschmittel erhöht wird, um die Oberflächenspannung zu verringern.
Glas
Es wird in der Glasherstellung verwendet, um das Vorhandensein kleiner Luftblasen in geschmolzenem Glas zu reduzieren oder zu beseitigen. Darüber hinaus beseitigt die Schlägerbildung während des Verfeinerungsprozesses mit geschmolzenem Glas.
Textilindustrie
Natriumsulfat wird als Unterricht verwendet, da es die Wechselwirkung von Farbstoffen mit Stofffasern erleichtert. In dem Farbstofftest wird detahydratisiertes Natriumsulfat verwendet.
Zusätzlich wird Natriumsulfat als Farbstoffverdünnungsmittel und Hilfsfärbemittel verwendet. wie direkte Farbstoffe, Schwefelfarbstoffe und andere Mittel, die Baumwollfärbung bevorzugen. Es wird auch als Mittel verwendet.
Medizin
Decahrides Natriumsulfat wird als Abführmittel verwendet, da es im Darm wenig absorbiert ist und daher im Lichte dieses Verursachen. Dies stimuliert die Zunahme peristaltischer Kontraktionen, die die Ausweisung des Darmgehalts induzieren.
Natriumsulfat ist ein Gegenmittel zur Kontrolle von Vergiftungen mit Barium und Bleisalzen. Glbaubert Salz ist wirksam zur Beseitigung bestimmter Medikamente übermäßig aufgenommen. Zum Beispiel Paracetamol (Acetoamiden).
Darüber hinaus wird es verwendet, um schlechte Elektrolyte mit Vorhandensein in isoosmotischen Lösungen zu liefern.
Trockenmittel
Natriumsulfat, weil es sich um ein inertes Reagenz handelt, wird zur Eliminierung von Wasser aus organischen Verbindungslösungen verwendet.
Rohmaterial
Natriumsulfat wird als Rohstoff zur Herstellung zahlreicher Substanzen verwendet, darunter: Natriumsulfid, Natriumcarbonat und Ammoniumsulfat.
Kann Ihnen dienen: GaschromatographieErhalten
Natriumsulfat wird durch Bergbauextraktion und chemische Reaktionen erhalten.
Bergbauextraktion
Es gibt drei Erz oder Mineralien, die mit kommerzieller Leistung ausgenutzt werden: theardita (NA2SW4), Mirabilita (NA2SW4· 10H2O) und die Glaubarita (NA2SW4·Fall4).
In Spanien werden die Ablagerungen dannardita und Mirabilita durch unterirdische Bergbau von Galerien und Säulen ausgenutzt. In der Zwischenzeit wird die Glauberita im Freien durch große Flöcke erhalten, die auf dem Mineraltank platziert werden.
Das Gelände wird mit geringer Intensitätsstrahlung hergestellt, um eine Porosität zu erzeugen, die Natriumsulfat -Auswaschung ermöglicht. Die Produktionsphase tritt mit Sprinklerbewässerung mit Süßwasser aus der Glauberita auf, deren Auslaugen auf absteigender Weise ausbreitet.
Die Natriumsulfat -Sole wird gesammelt, der Calciumsulfatrest wird gefüllt.
Chemische Produktion
Natriumsulfat wird während der Herstellung von Salzsäure durch zwei Prozesse erhalten: den Mannheim -Prozess und der Hardgrenave -Prozess.
Mannheim -Prozess
Es erfolgt in großen Stahlöfen und mit einer 6 -m -Stahlreaktionsplattform. Die Reaktion tritt zwischen Natriumchlorid und Schwefelsäure auf:
2 NaCl +H2SW4 => 2 HCl +Na2SW4
Hardreave -Prozess
Es umfasst die Reaktion von Natriumchlorid, Schwefeloxid, Sauerstoff und Wasser:
4 NaCl + 2 also2 + ENTWEDER2 + 2 h2O => 4 HCl +Na2SW4
Andere
Natriumsulfat tritt bei der Neutralisationsreaktion zwischen Natriumhydroxid und Schwefelsäure auf:
2 NaOH +H2SW4 => Na2SW4 + H2ENTWEDER
Natriumsulfat ist ein Nebenprodukt der Produktion zahlreicher Verbindungen. Es wird aus dem während der Herstellung des Viskose und des Cellophans entladenen Flüssigkeitsabfalls extrahiert. Auch bei der Produktion von Natriumdichromat, Phenolen, Borsäure und Lithiumcarbamat.
Risiken
Natriumsulfat wird als Verbindung mit geringer Toxizität angesehen. Es kann jedoch die Person, die es unangemessen verwendet.
Zum Beispiel können Sie Augenreizungen, Rötungen und Schmerzen verursachen. In der Haut kann es bei manchen Menschen Reizungen und Allergien verursachen. Seine Einnahme kann eine Reizung des Verdauungstrakts mit Übelkeit, Erbrechen und Durchfall verursachen. Und schließlich erzeugt seine Inhalation Reizungen im Atemweg.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Natriumsulfat. Abgerufen von: in.Wikipedia.Org
- Nationales Zentrum für Biotechnologie Information. (2019). Natriumsulfat. Pubchem -Datenbank. CID = 24436. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- B. N. Mehrotra. (1978). Die Kristallstruktur von Na2SW4III. Erholt von: RRUFF-2.Geo.Arizona.Edu
- Glauberita-thenardita (Natriumsulfat). [PDF]. Erholt von: Igme.Ist
- « Zinkoxid (ZnO) Struktur, Eigenschaften, Verwendung, Risiken
- Lactophenolblau -Eigenschaften, Zusammensetzung, Vorbereitung, verwendet »

