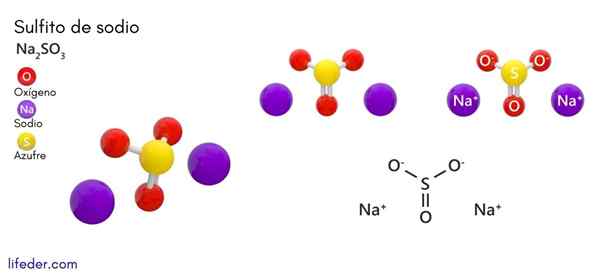
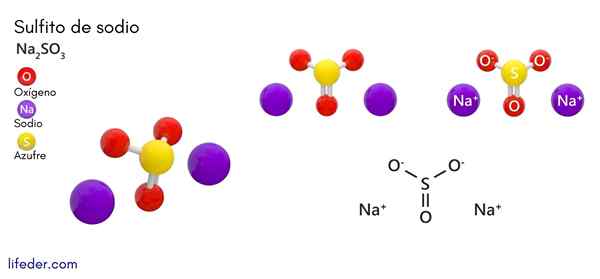
Natriumsulfit (Na2SO3)
- 2864
- 443
- Joy Hort
Was ist Natriumsulfit??
Er Natriumsulfit oder Natriumsulfit, deren chemische Formel na ist2SW3, Es handelt.
Zwischen 1650 und 1660 begann Glauber mit der Herstellung von Natriumsulfit aus allgemeinem Salz (NaCl) und konzentrierter Schwefelsäure. Dieser Prozess wird als Beginn der chemischen Industrie angesehen.
Der Sulfitprozess erzeugt Holzpulpa, das als fast reine Cellulosefaser beobachtet wird.
Somit haben Sulfite eine große Anzahl von Anwendungen verschiedener Typen, einschließlich der Lebensmittelindustrie als Additiv. Unter den relevantesten Funktionen, seine enzymatischen und nicht enzymatischen Bräunung, Kontrolle und Hemmung des mikrobiellen Wachstums, die Prävention der oxidativen Wurzel und die Modifikation der rheologischen Eigenschaften von Nahrungsmitteln.
Natriumsulfit -Präparation
Im Allgemeinen tritt Natriumsulfit im Laborskala aus der Reaktion der Natriumhydroxidlösung mit Schwefeldioxidgas auf (2naOH + SO2 → na2SW3 + H2ENTWEDER).
Dann die Entwicklung des SO2 Durch das Hinzufügen einiger Tropfen konzentrierter Salzsäure wird angegeben, ob Natriumhydroxid nahezu fehlt, in wässriges Natriumsulfit (Na2SW3 + 2HCl → 2nacl + so2 + H2ENTWEDER).
Andererseits wird diese chemische Verbindung industriell durch Reaktion von Sulfiddioxid mit einer Natriumcarbonatlösung erhalten.
Kann Ihnen dienen: spektrale NotationDie anfängliche Kombination erzeugt Natrium Bisulfit (Nahso3), Dass durch Reaktion mit Natriumhydroxid oder Natrium -Caroxid in Natriumsulfit umgewandelt wird. Diese Reaktionen können in der globalen Reaktion so zusammengefasst werden2 + N / A2CO3 → na2SW3 + CO2.
Chemische Struktur
Alle Formen von Natriumsulfit sind durch weiße, kristalline und hygroskopische Feststoffe gekennzeichnet, die die Fähigkeit haben, Wassermoleküle der Umgebung leicht anzuziehen und zu halten, die normalerweise bei Raumraumtemperatur liegen.
Die Art der kristallinen Struktur ist mit dem Vorhandensein von Wasser in der Verbindung verbunden. Anhydridnatriumsulfit zeigt eine ortorrombische oder hexagonale Struktur, und im Fall, dass Wassermoleküle in der Verbindung vorhanden sind, ändert sich die Struktur (z. B. zeigt Heptahydrat -Natriumsulfit eine monoklinische Struktur).
Eigenschaften
Diese Art hat bestimmte physikalische und chemische Eigenschaften, die sie von anderen Salzen unterscheiden, die nachstehend beschrieben werden:
Chemische Eigenschaften
Als gesättigte wässrige Lösung hat diese Substanz einen ungefähren pH -Wert von 9. Darüber hinaus oxidieren die Lösungen, die der Luft ausgesetzt sind.
Andererseits, wenn der Natriumsulfit der wässrigen Lösung bei Raumtemperatur kristallisieren kann. Heptahydrats -Kristalle aus dem Ausfluss in heißer und trockener Luft, sie oxidieren auch in der Luft, um Sulfat zu bilden.
In diesem Sinne ist die Anhydra -Form gegen die Luftoxidation viel stabiler. Sulfit ist mit Säuren, starken Oxidationsmitteln und hohen Temperaturen nicht kompatibel. Es ist auch in Ammoniak und Chlor unlöslich.
Kann Ihnen dienen: IsopropylalkoholPhysikalische Eigenschaften
Natriumsulfit mithydrider hat eine Molmasse von 126,43 g/mol, eine Dichte von 2.633 g/cm3, Ein Fusionspunkt von 33,4 ° C (92,1 ° F oder 306,5 K), ein Siedepunkt von 1.429 ° C (2.604 ° F oder 1.702 K) und ist nicht brennbar. Auch die Löslichkeit (gemessen bei einer Temperatur von 20 ° C) beträgt 13,9 g/100 ml.
Verwendet/Anwendungen
Aufgrund seiner reaktiven Eigenschaften ist Natriumsulfit sehr vielseitig und verwendet derzeit breite Arten von Branchen.
- Es wird häufig bei der Wasserbehandlung und der Beseitigung von gelösten Sauerstoff in Wasserkesseln verwendet.
- Es hat auch Anwendungen in der Papierindustrie (Semi -Kid -Zellstoff).
- In der Fotografie wird es zur Herstellung von Aufschluss verwendet.
- In geeignetem Maße wird es für die Erhaltung von Lebensmitteln und antioxidativen Verwendung verwendet.
- In der Textilindustrie wird es für Wäsche- und Antiklorprozesse verwendet.
- Es wird auch als Reduktionsmittel verwendet.
- Darüber hinaus wird es bei der sekundären Wiederherstellung von Ölbohrungen verwendet.
- Es wird sogar zur Herstellung von organischen Verbindungen, Farbstoffen, Tinten, viskosen Rayon und Gummi verwendet.
- Es wird bei der Herstellung zahlreicher Chemikalien verwendet, darunter Kaliumsulfat, Natriumsulfit, Natriumsilikat, Natriumhyposulfit und Natriumaluminiumsulfat.
Risiken
Auswirkungen für die Exposition gegenüber Verbindungen
Eine längere oder wiederholte Exposition gegenüber dieser Substanz kann Dermatitis und Empfindlichkeitsreaktionen verursachen. Exposition in sulfitempfindlich, asthmatisch und atopisch.
In ähnlicher Weise kann die Säure -Zersetzung von Natriumsulfit einen toxischen und gefährlichen Rauch von Schwefeloxiden, einschließlich Schwefeldioxid.
Kann Ihnen dienen: Ididio 192In ähnlicher Weise ist eine akute Vergiftung durch Schwefeldioxid selten, da Gas leicht zu erkennen ist. Es ist so irritierend, dass der Kontakt nicht toleriert werden kann.
Unter den Symptomen sind Husten, Gerüchte, Niesen, Riss und Atemschwierigkeiten enthalten. Mitarbeiter mit hoher unvermeidlicher Exposition können jedoch wichtige und möglicherweise sterbliche Lungenschäden erleiden.
Ökotoxizität
Natriumsulfit ist eine nicht verblüffende Lösung, die üblicherweise als Restwasserabläufe verwendet wird. Hohe Konzentrationen tragen zu einem hohen Nachfrage nach chemischer Sauerstoff in aquatischen Umgebungen bei.
Lebensmittelkonsum mit Konservierungsstoffen
Einer der Additive, das bei empfindlichen Personen Probleme verursachen kann2).
Bei überempfindlichen oder asthmatischen Menschen, dem Verzehr von Nahrungsmitteln mit Sulfiten oder dem Einatmen von Schwefeldioxid kann es giftig sein.
Diese Verbindungen sind für Bronchkonstruktion verantwortlich, die zu Atemschwierigkeiten führen. Die einzige Behandlung für diese übermäßige Reaktion besteht darin, Nahrung und Getränke zu vermeiden, die Sulfite enthalten.