Aluminiumsulfid (Al2s3) -Struktur, Eigenschaften, verwendet
- 3431
- 427
- Medine Kedzierski
Er Aluminiumsulfid (Zum2S3) Es ist eine hellgrau chemische Verbindung, die durch die Oxidation von metallischem Aluminium gebildet wird.
Damit dies geschieht und Aluminium seine Elektronen ergeben kann3, das gibt die Möglichkeit, Verbindungen zu Elektronen aus Schwefel zu bilden.
Wasser -Aluminium -Sulfidempfindlichkeit impliziert, dass in Gegenwart von Wasserdampf in der Luft mit Aluminiumhydroxid reagieren kann (AL (OH)3), Schwefelwasserstoff (H)2S) und Wasserstoff (h2) gasförmig; Wenn sich letztere ansammelt, kann eine Explosion verursacht werden. Daher sollte Aluminiumsulfidverpackung mit hermetischen Behältern durchgeführt werden.
Andererseits macht es ein Element, das kein Lösungsmittellösungsmittel aufweist, da Aluminiumsulfid Reaktivität mit Wasser hat.
Chemische Struktur
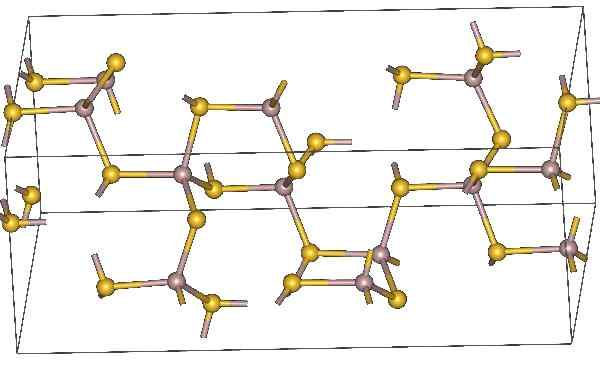
 Chemische Struktur von Aluminiumsulfid. Gelbe Atome repräsentieren Schwefel. Quelle: MaterialScientist, CC BY-SA 3.0, über Wikimedia Commons
Chemische Struktur von Aluminiumsulfid. Gelbe Atome repräsentieren Schwefel. Quelle: MaterialScientist, CC BY-SA 3.0, über Wikimedia Commons Molekularformel
Zum2S3
Strukturformel
 Nomenklatur
Nomenklatur
- Aluminiumsulfid.
- Di Aluminium Trisulfid.
- Aluminiumsulfid (III).
- Aluminiumsulfid.
Aluminiumsulfideigenschaften
 Aluminiumsulfid -Aussehen
Aluminiumsulfid -Aussehen Chemische Verbindungen zeigen meistens zwei Arten von Eigenschaften: physikalisch und chemisch.
Physikalische Eigenschaften
Molmasse
150,158 g/mol
Dichte
2,02 g/ml
Schmelzpunkt
1100 ° C
Wasserlöslichkeit
Unlöslich
Chemische Eigenschaften
Eine der Hauptreaktionen von Aluminiumsulfid ist mit Wasser wie Substrat oder Hauptreaktiv:

In dieser Reaktion kann die Bildung von Aluminiumhydroxid und die von Schwefelwasserstoffsulfid beobachtet werden. Seine Anwesenheit wird durch den Geruch von faulen Eiern identifiziert.
Kann Ihnen dienen: Chemische LösungenVerwendung und Anwendungen
In Super Cardpisors
Aluminiumsulfid wird bei der Herstellung von Nano -NETS -Strukturen verwendet, die die spezifische Oberfläche und die elektrische Leitfähigkeit verbessern, sodass eine hohe Kapazität und Energiedichte erreicht werden können, deren Anwendbarkeit die von Supercaugades ist.
Graphenoxid (GO) - Graphen ist eine der alotropen Kohlenstoffformen - hat als Aluminiumsulfidunterstützung gedient (AL2S3) Mit einer hierarchischen Morphologie ähnlich der von Nanorambután, die unter Verwendung der hydrothermalen Methode hergestellt wurde.
Graphenoxidwirkung
Die Eigenschaften von Graphenoxid als Träger sowie hohe elektrische Leitfähigkeit und Oberfläche machen das Nanorambutane2S3 elektrochemisch aktiv sein.
Die spezifischen CV -Kapazitätskurven mit gut definierten Redoxpeaks bestätigen das pseudokapacitive Verhalten des Nanorambutane2S3 Hierarchisch, in Graphenoxid in NaOH 1m -Elektrolyt anhaltend. Die spezifischen CV -Kapazitätswerte aus den Kurven sind: 168,97 an der 5MV/s -Explorationsgeschwindigkeit.
Darüber hinaus wurde eine gute galvanostatische Entladungszeit von 903 µs beobachtet, eine große spezifische Kapazität von 2178,16 zum Strom von 3 mA/cm -Strom2. Die aus der galvanostatischen Entladung berechnete Energiedichte beträgt 108,91 WH/kg zur Stromdichte von 3 mA/cm2.
Die elektrochemische Impedanz bestätigt somit die pseudokapacitive Natur der hierarchischen Nanorambutane -Elektrode an die2S3. Der Elektrodenstabilitätstest zeigt eine 57,84 % ige Aufbewahrung der spezifischen Kapazität von bis zu 1000 Zyklen.
Experimentelle Ergebnisse legen nahe, dass Nanorambutane2S3 Hierarchical eignet sich für Supercaiding -Anwendungen.
Kann Ihnen dienen: Chromhydroxid: Struktur, Eigenschaften, Synthese, verwendetIn sekundären Lithiumbatterien
Mit der Absicht, eine sekundäre Lithiumbatterie mit hoher Energiedichte zu entwickeln, wurde Aluminiumsulfid untersucht (AL2S3) als aktives Material.
Die anfängliche Download -Kapazitätsmaßnahme2S3 Es war ungefähr 1170 mAh G-1 bis 100 m G-1. Dies entspricht 62 % der theoretischen Kapazität für Sulfid.
Der Al2S3 Er zeigte eine schlechte Kapazitätsretention im potenziellen Bereich zwischen 0,01 V und 2,0 V, hauptsächlich aufgrund der strukturellen Irreversibilität des Lastprozesses oder der Extraktion von Li.
XRD- und K-XES-Analyse für Aluminium und Schwefel zeigten, dass die Oberfläche von AL2S3 reagiert während des Ladens und Entladensprozesses reversibel, während der Kern von AL2S3 Er zeigte strukturelle Irreversibilität, weil Lial und Li2S wurden aus Al gebildet2S3 Im ersten Download und dann blieben sie so wie sie waren.
Risiken
- In Kontakt mit Wasser freisetzt brennbare Gase, die spontan verbrennen können.
- Hautreizungen verursachen.
- Schwere Augenreizungen verursachen.
- Kann respiratorische Reizungen verursachen.
Informationen können je nach Verunreinigungen, Zusatzstoffen und anderen Faktoren zwischen Benachrichtigungen variieren.
Erste -Hilfe -Verfahren
Allgemeine Behandlung
Suchen Sie nach medizinischer Hilfe, wenn die Symptome bestehen bleiben.
Spezialbehandlung
Keiner
Wichtige Symptome
Keiner
Inhalation
Nehmen Sie das Opfer nach draußen. Sauerstoff liefern, wenn das Atmen schwierig ist.
Einnahme
Verwalten Sie ein oder zwei Gläser Wasser und induzieren Erbrechen. Niemals Erbrechen induzieren oder etwas im Mund an einen unbewussten Menschen geben.
Fell
Waschen Sie den betroffenen Bereich mit weicher Seife und Wasser. Löschen Sie kontaminierte Kleidung.
Augen
Waschen Sie Ihre Augen mit Wasser und blinken oft einige Minuten lang. Entfernen Sie die Kontaktlinsen für den Fall, dass Sie sie haben und weiter ausspülen.
Es kann Ihnen dienen: Cruise for Crucible: Eigenschaften, Funktionen, verwenden Sie BeispieleFeuerbekämpfungsmaßnahmen
Entzündbarkeit
Nicht brennbar.
Aussterbensmittel
Mit Wasser reagieren. Verwenden Sie kein Wasser: Verwenden Sie Co₂, Sand und Staublöscher.
Kampfverfahren
Verwenden Sie einen autonomen Atemapparat mit vollständigem Schutz. Tragen Sie Kleidung, um den Kontakt mit Haut und Augen zu vermeiden.
Verweise
- Gesundheit und Risiken.com, (s.f) Definition, Konzepte und Artikel über Gesundheit, Risiken und Umwelt. Abgerufen: Gesundheit und Risiken.com
- Aluminiumsulfid. (S.F). In Wikiwand. Abgerufen am 9. März 2018: Wikiwand.com
- Webelemente.(S.F).Dialuminium trisulpfid, geborgen am 10. März 2018: Webelemente.com
- LTS Research Laboratories, Inc (2016), Sicherheitsdatenblatt Aluminiumsulfid: LTschem.com

