Calciumsulfid (CAS) Struktur, Eigenschaften, erhalten, verwendet, verwendet
- 4203
- 284
- Timo Rabenstein
Er Calciumsulfid Es handelt. Es handelt.
Das CAS beim Auflösen in Wasser bildet verschiedene Verbindungen, weil der Schwefel Ion s2- wird Ion Sh- und OH -Ionen werden gebildet-. Die resultierende Lösung ist alkalisch. Diese Verbindung wird als Basis für Lumineszenzverbindungen verwendet oder die unter bestimmten Bedingungen sichtbares Licht erzeugen. Diese Materialien werden auch in leichten Gemälden verwendet.
 Cas Calciumsulfid wurde in einigen Meteoriten gefunden. Autor:. Quelle: Pixabay.
Cas Calciumsulfid wurde in einigen Meteoriten gefunden. Autor:. Quelle: Pixabay. CAS wurde als mögliche Medizin angesehen, um Herzprobleme und Blutgefäße wie Bluthochdruck oder hohen Druck zu behandeln. Dies ist eine Krankheit.
Mit Calciumsulfid können andere Verbindungen wie Calciumnitrat und Calciumcarbonat erhalten werden. Es muss mit Vorsicht behandelt werden und in Kontakt mit der Feuchtigkeit der Atmosphäre kann H erzeugen2S, was sehr giftig ist.
[TOC]
Struktur
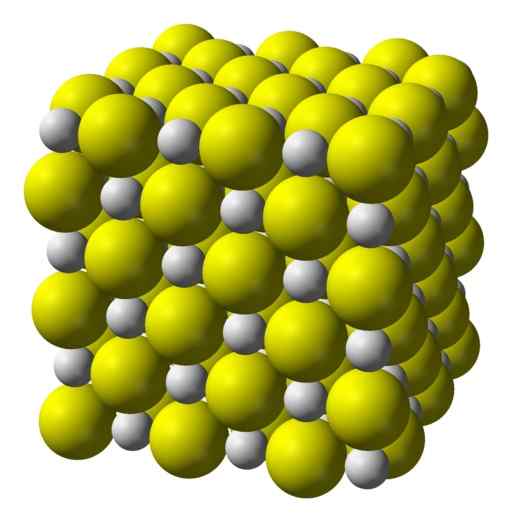
Calciumsulfid ist eine stark ionische Verbindung, die durch ein CA -Calciumion gebildet wird2+ und ein Sulfidionen s2-.
Kristallisieren in einer kubischen Struktur wie Steinsalz.
 Kubische kristalline Struktur von Calciumsulfid. Gelb = Schwefel; Weiß = Kalzium. Benjah-BMM27 / Public Domain. Quelle: Wikimedia Commons.
Kubische kristalline Struktur von Calciumsulfid. Gelb = Schwefel; Weiß = Kalzium. Benjah-BMM27 / Public Domain. Quelle: Wikimedia Commons. Nomenklatur
- Calciumsulfid
Physikalische Eigenschaften
Körperlicher Status
Gelbliche weiße kristalline feste, kubische Kristalle wie Natriumchlorid.
Molekulargewicht
72,144 g/mol
Schmelzpunkt
2528 ºC
Dichte
2,59 g/cm3
Löslichkeit
In Wasser löslich. Unlöslich in Ethanol.
Chemische Eigenschaften
Wässrige Lösung
Beim Auflösen in Wasser wird die CAS in seine Calcium -Ca -Ionen unterteilt 2+ und Sulfid s2-. Letzteres im Wasser nimmt ein Proton und wird zum SHH -Hydrosulfuro -Ion- Veröffentlichung eines OH -Hydroxylion-.
Kann dir dienen: siftedS2- + H2Oder ⇔ Sh- + Oh-
Daher sind Calciumsulfidlösungen alkalisch (sie haben einen basischen pH) und haben keine S -Ionen2- Aber Sh-.
Nur falls eine große Menge Alkali zu der Lösung wie NaOH -Natriumhydroxid zugesetzt wird. Das Gleichgewicht bewegt sich in Richtung der Bildung von Schwefelionen s s2-.
 Calciumsulfid löst sich in Wasser auf und bildet andere Verbindungen. Autor: Clker-Free-Vektor-Images. Quelle: Pixabay.
Calciumsulfid löst sich in Wasser auf und bildet andere Verbindungen. Autor: Clker-Free-Vektor-Images. Quelle: Pixabay. Das sh- Sie können einen weiteren Proton H nehmen H+ von Wasser, das Wasserstoffsulfid bildet, was eine sehr giftige Verbindung ist.
Sch- + H2Oder ⇔ h2S + Oh-
Daher bilden sich kleine Mengen H in Wasser2S und durch die Luftfeuchtigkeit der Umwelt ausgesetzt sein, gibt der CAS einen unangenehmen Geruch, der für Wasserstoffsulfid typisch ist.
Verbindungen vorhanden beim Auflösen in Wasser
Das Ergebnis der zuvor angegebenen Wasserreaktionen ist, dass Ca (SH) gebildet wird2, CA (OH)2 und ca (sh) (oh).
Cas + h2O → ca (sh) (OH)
Ca (sh) (oh) + h2O → CA (OH)2 + H2S
Säurebeaktion
Die gleichen Reaktionen, die im Wasser auftreten2S.
CAS + 2 HCl → CaCl2 + H2S
Andere Reaktionen
Wenn eine Calciumsulfidlösung mit Schwefel erhitzt wird, werden die Polysulfidionen erhalten42- und s32-.
Wenn der CAS in trockener Luft oder in reinem Sauerstoff erhitzt wird, wird die Verbindung zum Calciumsulfit -Fall oxidiert3 Und dann zum Calciumsulfatfall4:
2 cas + 3 o2 → 2 Fall3
2 Fall3 + ENTWEDER2 → 2 Fall4
Mit Oxidationsmitteln wie KCLO -Kaliumchlorat3, Kno Kaliumnitrat3 oder Dioxid führen2 Gewalttätige Reaktionen treten auf.
Erhalten
Calciumsulfid kann durch Kalzinierung (Erwärmung bei sehr hoher Temperatur) das Kalzium (Ca) und Schwefel (S) in inerter Atmosphäre hergestellt werden, dh sie sind nicht vorhanden.
Es kann Ihnen dienen: Chlorsäure (HCLO2)Ca + s + hitze → cas
Kann auch durch Erhitzen von Calciumsulfatfall erhalten werden4 Mit Kohle:
Fall4 + 2 c → cas + 2 co2
Im letzteren Fall wird jedoch ein reines Haus nicht erhalten, da es zusätzlich mit dem Fall reagiert4 CAO bilden und so2.
CAS wird auch durch Verbrennen von Kohleabfällen erzeugt.
Präsenz in der Natur
Der CAS ist natürlich im Oldhamite -Mineral präsent. Dies ist ein Bestandteil einiger Meteoriten und wichtig für die wissenschaftliche Forschung, die am Sonnensystem durchgeführt wird.
Es wird angenommen, dass die Oldhamita durch Kondensation im Nebel gebildet wurde, die das Sonnensystem stammten. Es ist auch in Vulkanen vorhanden.
 Cas Calciumsulfid befindet sich im Oldhamit -Mineral, das in einigen Meteoriten gefunden wurde. Leon Hupperichs/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons.
Cas Calciumsulfid befindet sich im Oldhamit -Mineral, das in einigen Meteoriten gefunden wurde. Leon Hupperichs/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0). Quelle: Wikimedia Commons. Darüber hinaus wird Calciumsulfid natürlich durch Reduktion des Falls erzeugt4 (Gips) möglicherweise durch die Wirkung von Bakterien.
Anwendungen
In leichten Materialien
Eine der am weitesten verbreiteten Verwendung von Calciumsulfid war als Grundlage für Lichtverbindungen. Dies sind Substanzen, die unter bestimmten Umständen sichtbares Licht emittieren.
In den Lumineszenzverbindungen von CAS wirkt dies als Basis und Aktivatoren werden der Struktur wie Chloriden bestimmter Elemente wie Cerio (CE3+) und Europio (EU2+).
Das von der CAS -Union und des Aktivator resultierende Material.
 Alte Computermonitore hatten Kathodenstrahlröhrchen, bei denen manchmal lumineszierende Verbindungen von Calciumsulfid und Aktivatoren verwendet werden. Autor: Andreas160578. Quelle: Pixabay.
Alte Computermonitore hatten Kathodenstrahlröhrchen, bei denen manchmal lumineszierende Verbindungen von Calciumsulfid und Aktivatoren verwendet werden. Autor: Andreas160578. Quelle: Pixabay. Sie werden auch in den aktuellen Lampen von Lichtdioden oder LED verwendet (Akronym für Englisch Leuchtdioden).
Kann Ihnen dienen: Ayaroína LED-Lampe. Einige können Lumineszenzverbindungen von Calciumsulfid enthalten. Kein maschinenlesbarer Autor zur Verfügung gestellt. Apper nahm an (basierend auf Urheberrechtsansprüchen). /CC BY-SA (http: // creativeCommons.Org/lizenzen/by-sa/3.0/). Quelle: Wikimedia Commons.
LED-Lampe. Einige können Lumineszenzverbindungen von Calciumsulfid enthalten. Kein maschinenlesbarer Autor zur Verfügung gestellt. Apper nahm an (basierend auf Urheberrechtsansprüchen). /CC BY-SA (http: // creativeCommons.Org/lizenzen/by-sa/3.0/). Quelle: Wikimedia Commons. Diese Materialien werden auch in leichten Gemälden und Lacken verwendet.
In Behandlung
Calciumsulfid wurde in medizinischen Studien als Arzneimittel zur Behandlung von arterieller Hypertonie (hoher Druck in Arterien) betrachtet. Dies ist eine Krankheit, die das kardiovaskuläre System vieler Menschen (Herz- und Blutgefäße) beeinflusst.
CAS gilt als "Spender" von H2S. Dies spielt eine wichtige Rolle bei der Regulierung des Tons oder der Stärke von Blutgefäßen, sodass die CAS -Verabreichung ein mögliches Mittel zur Behandlung von Bluthochdruck sein könnte.
 Calciumsulfid wurde als mögliches Mittel gegen den hohen Druck des kardiovaskulären Systems von kranken Menschen untersucht. Autor: Mohamed Hassan. Quelle: Pixabay.
Calciumsulfid wurde als mögliches Mittel gegen den hohen Druck des kardiovaskulären Systems von kranken Menschen untersucht. Autor: Mohamed Hassan. Quelle: Pixabay. Bei der Erlangung anderer Verbindungen
Calciumsulfid ermöglicht es, andere Verbindungen wie Calciumnitrat CA (nein3)2:
CAS + 2 HNO3 → CA (nein3)2 + H2S
Es wurde auch verwendet, um Caco Calciumcarbonat zu erhalten3. Dafür wird eine wässrige Lösung von CAS in Kohle eingereicht2:
Cas + h2Oder + co2 → h2S + Caco3
Andere Apps
Calciumsulfid wird auch als Additiv für Schmiermittel und als Flotationsmittel bei der Mineralgewinnung verwendet.
Risiken
Calciumsulfid kann Haut-, Augen- und Atemwegsreizungen verursachen. Muss mit Vorsichtsmaßnahmen und ordnungsgemäßen Sicherheitsimplementieren manipuliert werden.
Es ist eine sehr giftige Verbindung für das Wasserleben, daher ist sie für diese Umgebungen gefährlich.
Verweise
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Blei, d.R. (Editor). (2005). CRC -Handbuch für Chemie und Physik. 85th CRC Press.
- Ropp, r.C. (2013). Gruppe 16 (O, S, SE, TE) Alkalische Erdverbindungen. Sulfid Calcium. In Enzyklopädie der alkalischen Erdverbindungen. Von Scientedirect erholt.com.
- Li, und.F. et al. (2009). Calciumsulfid (CAS) zum Donor von Wasserstoffsulfid (H (2) S): ein neuer blutdrucksenkender Drarug? Med Hypothes, 2009 SEP; 73 (3): 445-7. NCBI erholte sich.NLM.NIH.Regierung.
- Haus j.UND. und Haus, k.ZU. (2016). Schwefel, Selen und Tellur. In Schwefel vorkommen. In der beschreibenden anorganischen Chemie (dritte Ausgabe). Von Scientedirect erholt.com.
- ODER.S. Nationalbibliothek für Medizin. (2019). Calciumsulfid. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Bier, m. et al. (2014). Umwandlung von Calciumsulfid in Calciumcarbonat während des Wiederherstellungsprozesses von elementaren Schwefel aus Gipsabfällen. Waste Manag, 2014 Nov; 34 (11): 2373-81. NCBI erholte sich.NLM.NIH.Regierung.
- « Quantitative Forschungsmerkmale, Techniken, Beispiele
- Calciumsilikateigenschaften, Struktur, erhalten, verwendet, verwendet »

