Kupfersulfidstruktur, Eigenschaften, verwendet

- 1513
- 75
- Ibrahim Steuk
Er Kupfersulfid Es ist eine Familie anorganischer Verbindungen, deren allgemeine chemische Formel Cu istXSUnd. Ja X Es ist größer als Und Dies bedeutet, dass dieses Sulfid kupferreicher ist als im Schwefel; und wenn im Gegenteil, X Es ist kleiner als Und, Dann ist Sulfid im Schwefel reicher als im Kupfer.
In der Natur überwiegen zahlreiche Mineralien, die natürliche Quellen dieser Verbindung darstellen. Fast alle von ihnen sind reicher als im Schwefel, und ihre Zusammensetzung wird durch die Formel mit ausgedrückt und vereinfachtXS; Hier X Sie können sogar Bruchwerte einnehmen, was auf einen stöchiometrischen Feststoff hinweist (Cu1.75S, zum Beispiel).
 Eine Probe von Covellita Mineral, eine der vielen natürlichen Kupfersulfidquellen. Quelle: James st. John [CC von 2.0 (https: // creativecommons.Org/lizenzen/by/2.0)]]
Eine Probe von Covellita Mineral, eine der vielen natürlichen Kupfersulfidquellen. Quelle: James st. John [CC von 2.0 (https: // creativecommons.Org/lizenzen/by/2.0)]] Obwohl der Schwefel im elementaren Zustand gelb ist, sehen seine Derivatverbindungen dunkle Farben aus; Dies tritt auch mit Kupfersulfid auf. Das Covelita -Mineral (überlegenes Bild), das hauptsächlich aus CUs besteht.
Sie können aus verschiedenen Kupfer- und Schwefelquellen hergestellt werden, wobei verschiedene Techniken verwendet werden und die Syntheseparameter variieren. So können Sie CUS -Nanopartikel mit interessanten Morphologien erhalten.
[TOC]
Kupfersulfidstruktur
Links
Diese Verbindung hat das Aussehen, kristallin zu sein, sodass Sie sofort denken können, dass sie aus Cu -Ionen besteht+ (Monovalentes Kupfer), Cu2+ (Zweiwertiges Kupfer), s2- E, sogar, s2- und s22- (Disulfuranionen), die durch elektrostatische Kräfte oder ionische Bindung interagieren.
Es gibt jedoch einen leichten kovalenten Charakter zwischen Cu und S, und daher kann die Cu-S-Verbindung nicht ausgeschlossen werden. Aus dieser Argumentation unterscheidet sich die kristalline Struktur des CUS (und die aller seiner abgeleiteten Feststoffe) von denen, die für andere ionische oder kovalente Verbindungen gefunden oder charakterisiert sind.
Mit anderen Worten, es kann nicht über reine Ionen gesprochen werden, aber inmitten seiner Attraktionen (Kation-Anion) gibt es eine leichte Überlappung der externen Orbitale (Elektronenfreigabe).
Koordinierungen in der Covelita
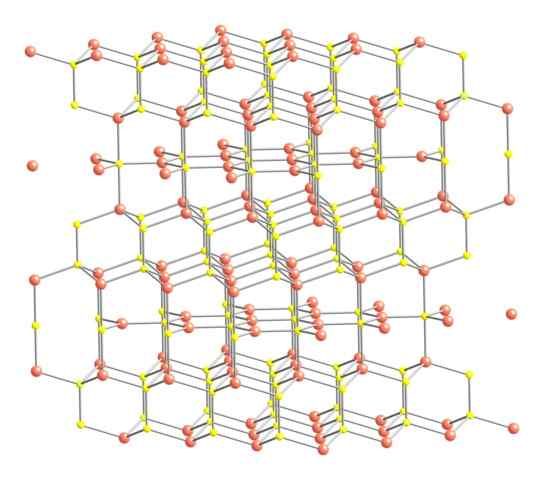 Kristalline Struktur der Covellita. Quelle: Benjah-BMM27 [Public Domain].
Kristalline Struktur der Covellita. Quelle: Benjah-BMM27 [Public Domain]. Trotzdem ist die kristalline Struktur des Covelits im Bild gezeigt. Es besteht aus hexagonalen Kristallen (definiert durch die Parameter ihrer Einheitszellen), bei denen die Ionen in verschiedenen Koordinationen binden und leiten; Diese sind mit einer unterschiedlichen Anzahl von Nachbarn in der Nähe.
Kann Ihnen dienen: Art der Verbindung von 02Im Bild werden Kupferionen mit rosa Kugeln dargestellt, während Schwefel mit gelben Kugeln.
Auf die Aufmerksamkeit zuerst auf rosa Kugeln wird angemerkt, dass einige von drei gelben Kugeln (trigonale flache Koordination) und anderen für vier (Tetraedrischkoordination) umgeben sind (Koordination).
Die erste Art von Kupfer, trigonal, kann in den Ebenen senkrecht zu den sechseckigen Gesichtern identifiziert werden, die sie dem Leser geben, in dem sie wiederum die zweite Art von Kohlenstoff, Tetraeder, sind.
Inzwischen haben einige fünf rosa Kugeln (trigonale Bipyramidenkoordination) und drei und eine gelbe Kugel (wiederum die Koordination der tetraedrischen Koordination). In letzterem ist es vor dem Disulfidanion, das sich nach unten und innerhalb der gleichen Struktur des Covelits visualisiert werden kann:
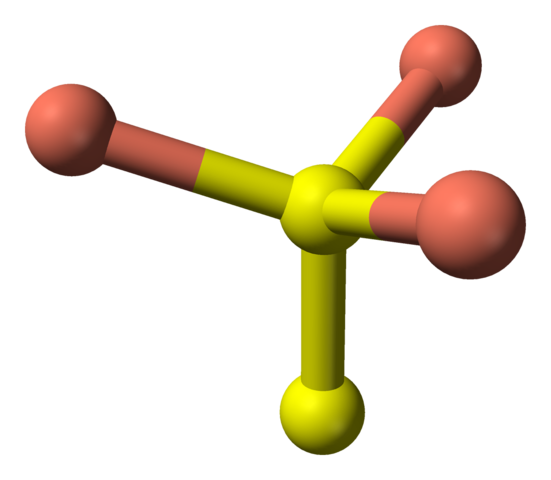 Tetraedrische Koordination des Disulfidanions in der Covellita. Quelle: Benjah-BMM27 [Public Domain].
Tetraedrische Koordination des Disulfidanions in der Covellita. Quelle: Benjah-BMM27 [Public Domain]. Alternative Formel
Es gibt dann Cu -Ionen2+, Cu+, S2- und s22-. Studien, die mit XPS -Photoelektronikspektroskopie (XPS) durchgeführt wurden, weisen jedoch darauf hin, dass alle Kupfer wie Kationen Cu sind+; Und daher wird die anfängliche CUS -Formel "besser" als (Cu+)3(S2–) (S2)- -.
Beachten Sie, dass die Beziehung cu: s für die vorherige Formel weiterhin 1 beträgt und auch die Lasten storniert werden.
Andere Kristalle
Ein Kupfersulfid kann ortorrombische Kristalle wie im Polymorph γ-Cu annehmen2S der Calcocita; kubisch, wie in einem anderen Polymorph von Calcozit, α-Cu2S; Tetragonal, im Anilita Mineral, Cu1.75S; monoklinisch in der Djurleita, Cu1.96S unter anderem.
Für jedes definierte Glas gibt es ein Mineral, und jedes Mineral hat seine eigenen Eigenschaften und Eigenschaften.
Eigenschaften
Allgemein
Die Eigenschaften von Kupfersulfid unterliegen der Beziehung cu: s ihrer Feststoffe. Zum Beispiel diejenigen, die Anionen präsentieren s22- Sie haben sechseckige Strukturen und können entweder Halbleiter oder metallische Leiter sein.
Kann Ihnen dienen: Kaliumphosphat (K3PO4): Struktur, Eigenschaften, verwendetWenn andererseits der Schwefelgehalt aus Anionen s besteht2-, Sulfide verhalten sich als Halbleiter und präsentieren auch ionische Leitfähigkeiten bei hohen Temperaturen. Dies liegt daran.
OPTICAL, obwohl es auch von seiner Kupfer- und Schwefelzusammensetzung abhängt, können Sulfide die Strahlung im Infrarotbereich des elektromagnetischen Spektrums absorbieren oder nicht. Diese optischen und elektrischen Eigenschaften machen potenzielle Materialien in verschiedenen Geräten implementiert.
Eine andere Variablen, die zusätzlich zur Cu -Beziehung berücksichtigt werden muss: S, ist die Größe der Kristalle. Es geht nicht nur um mehr "Schwefel" oder "Kupfer" Kupfersulfide, sondern die Abmessungen ihrer Kristalle verleihen ihren Eigenschaften eine ungenaue Wirkung; Daher sind Wissenschaftler bestrebt, Anwendungen für Nanopartikel Cu zu studieren und zu suchenXSUnd.
Covelita
Jedes Mineral- oder Kupfersulfid hat einzigartige Eigenschaften. Von allen ist die Covelita jedoch aus struktureller und ästhetischer Sicht am interessantesten (aufgrund seiner schillernden und blauen Töne). Daher werden einige seiner Eigenschaften nachstehend erwähnt.
Molmasse
95,611 g/mol.
Dichte
4,76 g/ml.
Schmelzpunkt
500ºC; Aber es bricht zusammen.
Wasserlöslichkeit
3.3 · 10-5 G/100 ml bei 18ºC.
Anwendungen
Nanopartikel in der Medizin
Variiert nicht nur die Größe der Partikel bis zur Reichweite. So kann Kupfersulfid Nanosphären, Stangen, Platten, Dünnfilme, Käfige, Kabel oder Röhrchen bilden.
Diese Partikel und ihre attraktiven Morphologien erwerben individuelle Anwendungen in verschiedenen Landen der Medizin.
Zum Beispiel können Nanojaulas oder leere Kugeln als Drogentransporter im Körper dienen. Nanosferas wurden verwendet, die von Kohlenstoffglas- und Kohlenstoffnanoröhren getragen wurden, um als Glukosedetektoren zu dienen. sowie ihre Aggregate sind empfindlich gegenüber Biomolekülenerkennungen wie DNA.
Es kann Ihnen dienen: 6 natürliche pH -Indikatoren und deren EigenschaftenCus -Nanoröhren übersteigen die Nanosferas beim Glukosetektion. Zusätzlich zu diesen Biomolekülen wurden Immunosensoren aus Dünnfilmen von CUs und bestimmten Stützen für den pathogenen Nachweis entworfen.
Nanokristalle und amorphe Aggregate von CUs können sogar Krebszellapoptose verursachen, ohne gesunde Zellen zu beschädigen.
Nanowissenschaft
Im vorderen Unterabschnitt wurde gesagt, dass ihre Nanopartikel Teil von Biosensoren und Elektroden waren. Zusätzlich zu solchen Verwendungszwecken haben Wissenschaftler und Techniker ihre Eigenschaften genutzt, um Solarzellen, Kondensatoren, Lithiumbatterien und Katalysatoren für sehr spezifische organische Reaktionen zu entwerfen. unverzichtbare Elemente in der Nanowissenschaft.
Es ist auch erwähnenswert, dass sich der NPCUS-CA-Set (CA: Aktivkohlenstoff und NP: Nanopartikel) als Entfernung von schädlichen Farbstoffen für den Menschen und daher als Reinigungsmittel von schädlicher Farbstoffen dienen Quellen aus Wasserquellen, die unerwünschte Moleküle absorbieren.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Kupfersulfid. Abgerufen von: in.Wikipedia.Org
- Ivan Grozdanov und Methodija Najdoski. (1995). Optische und elektrische Eigenschaften von Kupfersulfidfilmen von variabler Zusammensetzung. Journal of Solid State Chemistry Band 114, Ausgabe 2, 1. Februar 1995, Seiten 469-475. doi.org/10.1006/JSSC.1995.1070
- Nationales Zentrum für Biotechnologie Information. (2019). Kupfersulfid (CUS). Pubchem -Datenbank. CID = 14831. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Peter a. Ajibade und Nandiphha l. Botha. (2017). Synthese, optische und strukturelle Eigenschaften
- Kupfersulfid -Nanokristalle aus Einzelmolekül -Vorläufern. Abteilung für Chemie, Universität Fort Hare, Privatbeutel X1314, Alice 5700, Südafrika. Nanomaterialien, 7, 32.
- Zusammenarbeit: Autoren und Herausgeber der Bände III/17E-17F-41C (s).F.). Kupfersulfide (Cu2s, Cu (2-x) S) Kristallstruktur, Latice-Parameter. In: Madelung oder., Rössler u., Schulz m. (Hrsg.) Nicht-Tetraedrally-gebundene Elemente und binäre Verbindungen I. Landolt-Börnstein-Gruppen-III-Kondensation (numerische Daten und funktionelle Beziehungen in Wissenschaft und Technologie), Vol 41C. Springer, Berlin, Heidelberg.
- Momtan, f., Vafaei, a., Ghaedi, m. et al. Koreanisch J. Chem. Eng. (2018). Anwendung von Kupfersulfid -Nanopartikeln beladener aktivierter Kohlenstoff für die gleichzeitige Adsorption von Terarmfarbstoffen: Reaktionsoberfläche Methodik. 35: 1108. doi.org/10.1007/S11814-018-0012-1
- Goel, s., Chen, f., & Cai, w. (2014). Synthese und biomedizinische Anwendungen von Kupfersulfid -Nanopartikeln: von Sensoren zur Theranostik. Klein (Weinheim an der Bergstraße, Deutschland), 10 (4), 631-645. Doi: 10.1002/smll.201301174

