Zinksulfid (Zns)
- 4338
- 970
- Said Ganzmann
 Zinksulfid. Quelle: Wikimedia Commons
Zinksulfid. Quelle: Wikimedia Commons Was ist Zinksulfid?
Er Zinksulfid Es ist eine anorganische Verbindung der Formel ZNS, gebildet durch Zn -Kationen2+ und Anionen s2-. Es ist in der Natur hauptsächlich als zwei Mineralien vorhanden.
Der Sphenhell wird aufgrund der Verunreinigungen, die sie präsentiert, in schwarzer Natur präsentiert. Präsentiert nur weiße Kristalle, während die Wurtzita graue weiße Kristalle hat.
Zinksulfid ist in Wasser unlöslich. Es kann Umweltschäden verursachen, da es den Boden durchdringt und das Grundwasser und ihre Strömungen verunreinigt.
Zinksulfid kann unter anderem Korrosion und Neutralisation auftreten.
Durch Korrosion:
Zn +h2S => Zns +H2
Durch Neutralisation:
H2S +Zn (OH)2 => Zns +2H2ENTWEDER
Zinksulfid ist ein phosphoreszierendes Salz, das ihm die Kapazität mehrerer Verwendungen und Anwendungen verleiht. Darüber hinaus ist es ein Halbleiter und eine Photokatisierung.
Zinksulfidstruktur
Zinksulfid nimmt kristalline Strukturen an, die von elektrostatischen Anziehern zwischen dem Zn -Kation bestimmt werden2+ und Anion s2-. Dies sind zwei: die Spheny- oder Zink -Blenda und die Wurmita. Bei beiden Ionen minimieren die Abstoßungen zwischen gleichen Ionen.
Die Zinkmischung ist unter terrestrischen Druck- und Temperaturbedingungen am stabilsten. Und die Wurzita, die weniger dicht ist, resultiert aus der kristallinen Reorganisation aufgrund des Temperaturanstiegs.
Die beiden Strukturen können gleichzeitig im selben Zns -Feststoff koexistieren, obwohl die Wurmita sehr langsam überwiegend endet.
Zink Blenda
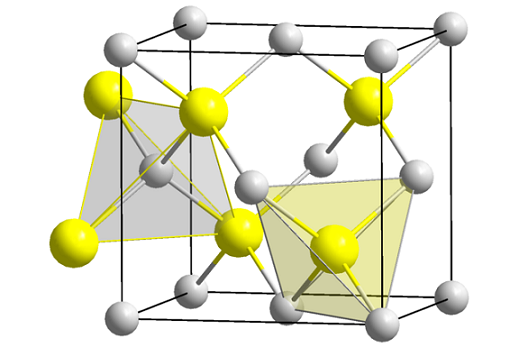
 Zink Blenda -Struktur (Spheny). Quelle: Wikimedia Commons
Zink Blenda -Struktur (Spheny). Quelle: Wikimedia Commons Das überlegene Bild zeigt die Kubikzelle, die auf den Gesichtern der Zink -Blenda -Struktur zentriert ist. Die gelben Kugeln entsprechen den S -Anionen2-, und grau bis zn Kationen2+, befindet sich in den Ecken und in den Zentren der Würfelgesichter.
Kann Ihnen dienen: Isobutil: Nomenklatur, Schulung, Struktur und EigenschaftenBeachten Sie die tetraedrischen Geometrien um die Ionen. Zink Blenda kann auch durch diese Tetraeder dargestellt werden, deren Löcher im Glas die gleiche Geometrie haben (tetraedrische Hohls).
Außerdem wird der ZnS -Anteil innerhalb der Einheitszellen erfüllt; das heißt, ein Anteil 1: 1. Somit für jedes Zn -Kation2+ Es gibt einen Anion s2-. Im Bild scheint es, dass graue Kugeln im Überfluss vorhanden sein, aber in Wirklichkeit, wenn sie in den Ecken und in der Mitte der Hub -Gesichter sind, werden sie von anderen Zellen geteilt.
Wenn beispielsweise die vier gelben Kugeln, die sich in der Box befinden, entnommen werden, sollten die „Teile“ aller grauen Kugeln das gleiche hinzufügen (und dies tun), vier. Somit gibt es in der kubischen Einheitszelle vier Zn2+ und vier s2-, Der Zns stöchiometrische Anteil wird erfüllt.
Ebenso ist es wichtig zu betonen, dass es tetraedrische Löcher nach vorne und hinter den gelben Kugeln gibt (der Raum, der sie voneinander trennt).
Wurmita
 Wurzitstruktur. Quelle: Wikimedia Commons
Wurzitstruktur. Quelle: Wikimedia Commons Im Gegensatz zur Struktur der Zinkmischung nimmt die Wurmita ein hexagonales kristallines System an (überlegenes Bild). Dies ist weniger kompakt, daher hat der Feststoff weniger Dichte.
Die Ionen in der Wurmita haben auch tetraedrische Umgebungen und einen Anteil von 1: 1, der mit der ZnS -Formel übereinstimmt.
Zinksulfideigenschaften
Farbe
Es kann auf drei Arten dargestellt werden:
-Die Wurtzita von weißen und sechseckigen Kristallen.
-Der Sphenhell von weißen Rican-Kristallen und Kubikkristallen.
-Als weißes bis graues oder gelblich weißes weißes Pulver und kubische gelbliche Kristalle.
Schmelzpunkt
1.700 ° C.
Wasserlöslichkeit
Praktisch unlöslich (0,00069 g/100 ml bei 18 ° C).
Löslichkeit
Unlöslich in Alkalien, löslich in verdünnten Mineralsäuren.
Dichte
Kugeln 4,04 g/cm3 und Wurtzita 4,09 g/cm3.
Härte
Es hat eine Härte von 3 bis 4 auf der MOHS -Skala.
Stabilität
Wenn Wasser langsam enthält, oxidiert langsam Sulfat. In einer trockenen Umgebung ist es stabil.
Zersetzung
Wenn er bei hohen Temperaturen erhitzt wird, emittiert er giftige Zink- und schwefelige Oxide Dämpfe.
Es kann Ihnen dienen: Natriumhydrid (NAH): Eigenschaften, Reaktivität, Gefahren, VerwendungenZinksulfidnomenklatur
Die elektronische Konfiguration des Zn ist [ar] 3D104s2. Wenn Sie die beiden Elektronen des 4S -Orbitals verlieren, ist es wie das Zn -Kation2+ Mit seinen Orbitalen voller. Daher, seit elektronisch das Zn2+ Es ist viel stabiler als der Zn+, Es hat nur eine Valenz von +2.
Daher wird es für die Aktiennomenklatur weggelassen und fügt seine in Klammern eingeschlossene Wertigkeit und mit römischen Zahlen hinzu: Zinksulfid (II).
Systematische und traditionelle Nomenklaturen
Es gibt jedoch noch andere Möglichkeiten, ZnS neben der bereits erhobenen ZnS anzurufen. In der systematischen. Somit wird der Zns als: BrötchenZinksulfid (und nicht Monozinc -Monosulfuro).
In Bezug auf die traditionelle Nomenklatur zum Zink wird es beim Hinzufügen des Suffix -co hinzugefügt, wenn es eine einzige Valenz von +2 hat. Folglich ist sein traditioneller Name: Zínc -SulfidICO.
Zinksulfid verwendet
Als Pigmente oder Beschichtungen
Sachtolith
Der Sattholith ist ein weißes Pigment aus Zinksulfid. Es wird in Putties, Mastiquen, Dichtungsmitteln, niedrigeren Abdeckungen, Latexfarben und Beschilderungen verwendet.
Seine Verwendung in Kombination mit absorbierenden Pigmenten von ultraviolettem Licht wie Mikro -Titan oder transparenten Eisenoxidpigmenten ist bei wetterresistenten Pigmenten erforderlich.
Zns und Latexgemälde
Wenn ZnS in Latex- oder strukturierten Gemälden angewendet wird, hat es eine längere Mikrobizidwirkung.
Fenster und Flugzeugrahmen
Aufgrund seiner großen Härte und seiner Beständigkeit gegen Bruch, Erosion, Regen oder Staub ist es für Außeninfrarotfenster oder in den Flugzeugrahmen geeignet.
Beschichtung und andere Verwendung
Das ZnS wird bei der Beschichtung von Rotoren verwendet, die beim Transport von Verbindungen verwendet werden, um den Verschleiß zu verringern. Darüber hinaus wird es bei der Herstellung von Drucktinten, Isolierverbindungen, thermoplastischer Pigmentierung und Kunststoff, die gegen elektrolumineszierende Flammen und Lampen resistent sind.
Kann Ihnen dienen: Tunsen leichter: Eigenschaften, Funktionen, Beispiele des GebrauchsNachtsichtgeräte und Bildschirme
-Zinksulfid kann transparent sein und als Fenster für sichtbare Optik und Infrarotoptik verwendet werden können. Es wird in Nachtsichtgeräten, auf Fernsehbildschirmen, Radarbildschirmen und fluoreszierenden Beschichtungen verwendet.
Elektrolumineszenz
ZnS -Doping mit Cu wird zur Herstellung von Elektrolumineszenzplatten verwendet. Zusätzlich wird es in Raketenantrieb und Gravimetrie verwendet.
Für seine Phosphoreszenz
Seine Phosphoreszenz wird verwendet, um die Taktnadeln zu färben und so die Zeit im Dunkeln zu visualisieren. Auch in Gemälden für Spielzeug, Notsignale und Verkehrshinweise.
Die Phosphoreszenz ermöglicht die Verwendung von Zinksulfid in Kathodenstrahlröhren und auf X -Strahl -Bildschirmen, um in dunklen Punkten zu glänzen. Die Farbe der Phosphoreszenz hängt vom verwendeten Aktivator ab.
Halbleiter, Photokatisierung und Katalysator
- Die Spheny und der Wurtzit sind Breitbandspalten Halbleiter. Der Sphalerit hat eine 3,54 EV -Bandspalte, während die Wurtzita ein 3,91 EV -Band -Bit hat.
- Das Zns wird zur Herstellung eines Photokatalysators verwendet, der aus CDs - Zns/Zirkonium - Titanphosphat besteht, das für die Wasserstoffproduktion unter sichtbarem Licht verwendet wird.
- Stellt als Katalysator für den Abbau organischer Schadstoffe ein. Es wird zur Vorbereitung eines Farbsynchronisators in LED -Lampen verwendet.
- Seine Nanokristalle werden für den ultrasiblen Proteinerkennung verwendet. Zum Beispiel durch Ausgabe von Quantenpunkten von Zns. Es wird zur Herstellung eines kombinierten Photokatalysators (CDS/ZNS) -TIO2 zur elektrischen Produktion durch Photoelektrokatalyse verwendet.
Verweise
- Pubchem (2018). Zinksulfid. Entnommen aus: Pubchem.NCBI.NLM.NIH.Regierung
- Quiminet (16. Januar 2015). Weißes Pigment basierend auf Zinksulfid. Erholt von: Quiminet.com
- Wikipedia (2018). Zinksulfid. Genommen von: in: in.Wikipedia.Org
- II-VI UK (2015). Zinksulfid (Zns). Genommen von: ii-vi.Ist
- Rob Toreki (30. März 2015). Die Znincblende (ZnS) -Struktur. Entnommen aus: ilpi.com
- Chemistry Librettexts (22. Januar 2017). Struktur-Zink-Mischung (Zns). Genommen von: Chem.Librettexts.Org
- Reade (2018). Sulfidsulfid/ Zink (Zns). Genommen von: Reade.com

