Lieferung verschiedener Eigenschaften, Struktur, Funktionen
- 2910
- 423
- Rieke Scheer
Der Dysmutas Superoxid (Seit) entweder Oxidortiertes Superoxid, Sie bilden eine Familie allgegenwärtiger Enzyme in der Natur, deren Hauptfunktion bei der Verteidigung von aeroben Organismen gegen sauerstofffreie Radikale, insbesondere Superoxidanion -Radikale, besteht.
Die Reaktion, die diese Enzyme katalysieren.
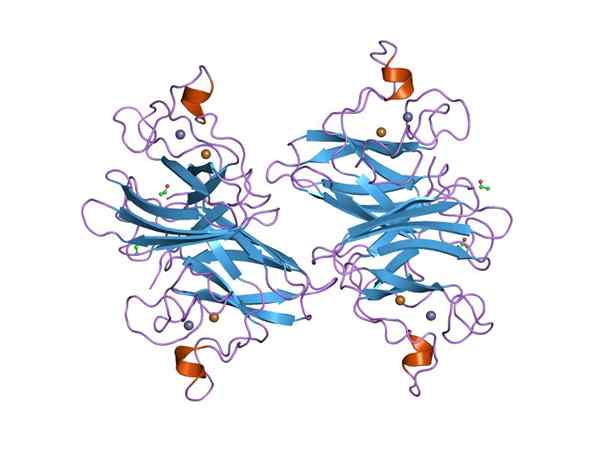
 Grafische Darstellung eines Dymputase-Superoxids (SOD) Cu-Zn (Quelle: Jawahar Swaminathan und MSD-Mitarbeiter des Europäischen Bioinformatikinstituts [Public Domain] über Wikimedia Commons) über Wikimedia Commons)
Grafische Darstellung eines Dymputase-Superoxids (SOD) Cu-Zn (Quelle: Jawahar Swaminathan und MSD-Mitarbeiter des Europäischen Bioinformatikinstituts [Public Domain] über Wikimedia Commons) über Wikimedia Commons) Viele Krankheiten bei Tieren hängen mit der Akkumulation verschiedener reaktiver Sauerstoffspezies zusammen, und das gilt für Pflanzen, da die Umwelt zahlreiche und konstante Arten von oxidativem Stress auferlegt.
Diese Gruppe von Enzymen wurde 1969 von McCord und Fridovich entdeckt, und seitdem wurden beträchtliche Fortschritte in Bezug auf diese Enzyme und die Reaktionen erzielt, die in Lebewesen katalysieren.
[TOC]
Eigenschaften
Dysmutas -Superoxid reagieren mit Superxidradikalen auf wirklich hohe Raten, was zu einer sehr wirksamen Verteidigungslinie für die Entfernung dieser Moleküle führt.
Bei Säugetieren wurden mindestens drei Isoformen für Overroxiddysmutase beschrieben, die als SOD1, SOD2 bzw. SOD3 bekannt sind.
Zwei dieser Isoformen haben Kupfer- und Zinkatome in ihren katalytischen Zentren und unterscheiden sich in Bezug auf ihre Lage voneinander: intrazellulär (cytosolisch, SOD1 oder Cu/Zn-SOD) oder mit extrazellulären Elementen (EC-SOD oder SOD3).
Die SOD2- oder Mn-SOD.
SOD1 -Isoenzyme sind hauptsächlich in Cytosol, obwohl sie auch im Kernkompartiment und Lysosomen nachgewiesen wurden. Im Gegenteil.
Kann Ihnen dienen: Wie verändern sich die Lebewesen im Laufe der Zeit??Jede dieser Isoformen wird von verschiedenen Genen codiert, aber zur gleichen Familie und ihrer Transkriptionsregulation wird im Wesentlichen durch extrazelluläre Bedingungen gesteuert, die unterschiedliche interne Signalwasserfälle auslösen.
Anderes dishnliches Superoxid
Dysmonisches Superoxid mit katalytischen Stellen, die Kupfer- und Zink- oder Manganionen haben.
Es gibt eine zusätzliche Gruppe von Dysmutas -Superoxid, die bei Säugetieren nicht vorhanden sind und die leicht erkennbar sind, da sie an ihrem aktiven Ort Eisen anstelle einer der drei zuvor für die anderen Klassen von dysmatösen Superoxid beschriebenen Ionen haben.
In UND. coli, Das Overroxid -Dysmi, das Eisen enthält. Dieses Enzym ähnelt dem in den Mitochondrien vieler Eukaryoten.
Die Pflanzen haben die drei Arten von Enzymen: diejenigen, die Kupfer und Zink (Cu/Zn-SOD) enthalten, die Mangan (Mn-SOD) und diejenigen, die Eisen (Fe-SOD) enthalten, in ihrem aktiven Zentrum und in diesen Organismen, die sie trainieren, enthalten Analoge Funktionen zu denen von nicht-vegetalen Enzymen.
Reaktion
Dysmy-superoxid-Enzymsubstrate sind Superoxidanionen, die als O2- und Zwischenverbindungen im Sauerstoffreduktionsprozess dargestellt werden.
Die Reaktion, die sie katalysieren, kann in allgemeinen Linien wie der Transformation (Disputation) freier Radikale zur Bildung von molekularem Sauerstoff und Wasserstoffperoxid in Betracht gezogen werden, die als Substrat aus anderen Enzymen an die Umwelt oder Mitarbeiter freigesetzt werden.
Kann Ihnen dienen: Glucans: Struktur, Eigenschaften und FunktionenWasserstoffperoxid kann anschließend dank der Wirkung einer der But -Peroxidase- und Katalase -Glutathion -Enzyme aus Zellen eliminiert werden, die auch wichtige Funktionen im Zellschutz ausüben.
Struktur
Dysmutas -Superoxid -Isoenzyme beim Menschen können sich in Bezug auf bestimmte strukturelle Aspekte voneinander unterscheiden. Zum Beispiel beträgt das SOD1 -Isoenzym 32 kDa -Molekulargewicht, während SOD2 und SOD3 Homotetrie von 95 bzw. 135 kDa -Molekulargewicht sind.
Die andere Gruppe dysmatöser Superoxids, die in Pflanzen und anderen Organismen als Säugetieren vorhandene Fe-Sod.
In einigen Pflanzen enthalten diese Fe-SOD eine mutmaßliche N-terminale Signalsequenz für den Transport im Inneren von Chloroplasten, und andere enthalten einen Triquertransport-C-terminale Sequenz zu Peroxisomen, sodass angenommen wird, dass seine subzelluläre Verteilung beide Kompartimente einschränken.
Die molekulare Struktur der drei Arten von Überexidenzymen wird im Wesentlichen von Alpha-Propellern und B-geflogenen Blättern konsultiert.
Funktionen
Dysmonisches Superoxid verteidigt Zellen, Organe und Körpergewebe von Schäden, die sauerstofffreie Radikale wie Lipidperoxidation, Proteindesaturierung und Mutagenese der DNA verursachen können.
Bei Tieren können diese reaktiven Arten auch Herzläsionen verursachen, das Altern beschleunigen und an der Entwicklung entzündlicher Erkrankungen teilnehmen.
Pflanzen erfordern auch die wesentliche enzymatische Aktivität von Overoxiddysmutase, da viele stressige Umweltbedingungen oxidativen Stress erhöhen, dh die Konzentration deleteröser reaktiver Spezies.
Bei Menschen und anderen Säugetieren haben die drei für Overroxiddysmutase beschriebenen Isoformen unterschiedliche Funktionen. Das SOD2 -Isoenzym beispielsweise nimmt beispielsweise an der Zelldifferenzierung und Tumorogenese sowie an dem Schutz gegen hyperoxie induzierte Lungentoxizität (hohe Sauerstoffkonzentration) teil.
Kann Sie dienen: Inulin: Struktur, Eigenschaften, Lebensmittel, KontraindikationenFür einige Arten von pathogenen Bakterien fungieren SOD -Enzyme als "Virulenzfaktoren", die es ihnen ermöglichen, viele oxidative Stressbarrieren zu überwinden, denen sie während des Invasionsprozesses konfrontiert werden können.
Verwandte Krankheiten
Eine Abnahme der Superoxiddysmutase -Aktivität kann durch verschiedene Faktoren, sowohl intern als auch extern. Einige beziehen sich auf direkte genetische Defekte in der kodierenden Gene für SOD -Enzyme, während andere indirekt sein können, die mit der Expression von regulatorischen Molekülen zusammenhängen.
Eine große Anzahl pathologischer Erkrankungen des Menschen hängen mit SOD -Enzymen zusammen, einschließlich Fettleibigkeit, Diabetes, Krebs und anderen.
In Bezug auf Krebs wurde festgestellt, dass es eine große Anzahl von Krebstumoren gibt, die einen geringen Spiegel eines der drei Säugetiere aufweisen (SOD1, SOD2 und SOD3).
Oxidativer Stress, dass die Superoxiddismutaseaktivität verhindert, ist auch mit anderen Gelenkpathologien wie Arthrose, rheumatoider Arthritis, verbunden. Viele dieser Krankheiten haben mit der Expression von Faktoren zu tun, die die SOD-Aktivität hemmen, wie z. B. TNF-α-Faktor.
Verweise
- Fridovich, ich. (1973). Swiden Dysmuta. Annu. Rev. Biochem., 44, 147-159.
- Johnson, f., & Giulivi, c. (2005). Superoxiddysmute und die IM -Auswirkungen auf die menschliche Gesundheit. Aspekte der Medizinmolekular, 26, 340-352.
- Oberley, l. W., & Bueftner, g. R. (1979). Rolle der Superoxiddistine bei Krebs: eine Übersicht. Krebsforschung, 39, 1141-1149.
- Taylor, p., Bowler, c., Camp, w. Van, Montagu, m. Van, Inzé, D., & Geröstet, k. (2012). Superoxid in Pflanzen entleert. Kritische Bewertungen in Pflanzenwissenschaften, 13(3), 37-41.
- Zelko, ich., Mariani, t., & Folz, r. (2002). Superoxid-Distam-Multiigenfamilie: Im Vergleich der Genstrukturen von Cuzn-SOD (SOD1), Mn-SOD (SOD2) und EC-SOD (SOD3), Evolution und Expression. Freie Radikalbiologie & Medizin, 33(3), 337-349.
- « Oligosaccharide Eigenschaften, Zusammensetzung, Funktionen, Typen
- José Rubén Romero Biographie, Stil, arbeitet »

