Aromatischer elektrophiler Substitutionsmechanismus und Beispiele

- 1002
- 74
- Luca Holdt
Der Aromatische elektrophile Substitution . Diese Reaktion entgegenwirkt den Ergänzungen, die Alkene erlitten haben.
Der Elektrophile wird oft während desselben molekularen Mechanismus erzeugt, Produkt der Mischung der Reagenzien und eines Katalysators, der aus einer Säure von Lewis besteht, zum Beispiel alle3 oder fecl3. Diese Katalysatoren erhöhen die Avidität des Elektrophilen durch die Elektronen des aromatischen Rings und beschleunigen dadurch die Reaktion.
 In der aromatischen elektrophilen Substitution ist es der Benzolring, der den Elektrophilen angreift. Quelle: Gabriel Bolívar über Molview.
In der aromatischen elektrophilen Substitution ist es der Benzolring, der den Elektrophilen angreift. Quelle: Gabriel Bolívar über Molview. In dem überlegenen Bild haben wir eine einfache Darstellung des elektrophilen Benzolangriffs auf den Elektrophilen und+. Beachten Sie, dass der Angriff aus den Elektronen einer seiner Doppelbindungen stammt; Das heißt, es sind die Elektronen des konjugierten π -Systems, die den Sear starten.
Diese Reaktion ermöglicht es Benzol und anderen aromatischen Verbindungen, Substituenten wie OH -Gruppen zu erwerben, nicht2, SW3H, Cl, Br, R, Cor, Coch3, unter anderen. Zum Beispiel wird das Phenol über Sear ab Benzol und anderen Derivaten synthetisiert.
[TOC]
Aromatischer elektrophiler Substitutionsmechanismus
Schritt 1: Elektrophylischer Angriff
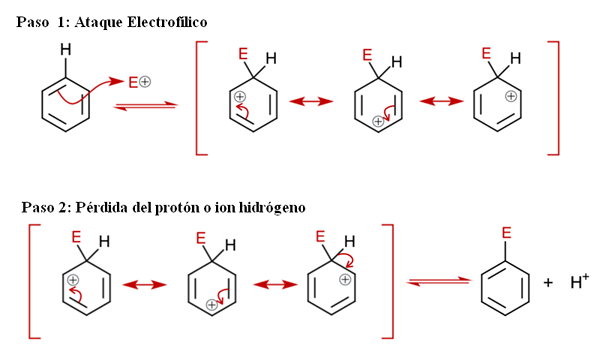 Allgemeiner Mechanismus für die Sear. Quelle: Soonlorpai über Wikipedia.
Allgemeiner Mechanismus für die Sear. Quelle: Soonlorpai über Wikipedia. Im überlegenen Bild wird der Mechanismus der aromatischen elektrophilen Substitution ausführlicher dargestellt. Eine der drei Doppelbindungen von Benzol greift den Elektrophilen an und+, Eine zwischengegebene Art, die als Ion Arenio bekannt ist (delokalisierte Cyclohexadien), in roten Klammern gesperrt ist.
Kann Ihnen dienen: Chemischer NiederschlagBeachten Sie, dass die positive Belastung von e+ Bewegen Sie sich nun in den Innenraum des Rings. Aber nicht nur das: Es verlagert zwischen drei Kohlenstoffatomen in ortho (benachbarten) Positionen und für (gegenüberliegende) zu Kohlenstoff, die mit E (C-E) verbunden sind. Dieser Vermittler existiert genau dank der Stabilität, die durch seine Resonanzstrukturen verliehen wird.
Schritt 2: Verlust des Protons oder Wasserstoffions
Das Arenio -Ion muss jedoch seine positive Belastung bald neutralisieren, indem ein Wasserstoffproton oder Ion verliert wird. Hier gipfelt Ersatz gipfelt. Die elektrophile e+ ersetzt daher eines der Benzolhydrollee und lässt dies als Ion H. ersetzt+ außerhalb des Rings, damit positive Gebühren erhalten bleiben.
Wenn es sorgfältig beobachtet wird, befinden sich alle Schritte im Gleichgewicht, sodass der Ersatz reversibel ist. Das heißt, wenn die Konzentrationen von H erhöht sind+, Dann ersetzt ein Wasserstoff E und wir erhalten die Reagenzien wieder.
Beispiele für aromatische elektrophile Substitution
Benzol
Der Benzol -Sear ist der einfachste von allen, der bereits oben dargestellt wird. Jedes der Hydrogene können durch e ersetzt werden+, Weil alle chemisch äquivalent sind.
Es gibt keine Unterschiede voneinander. Daher ist die Wahrscheinlichkeit, dass ein Austausch in einem der sechs Kohlenstoffatome auftritt. Alles ändert sich jedoch, wenn im Benzenischen Ring andere Substituenten vorhanden sind, wie wir unten sehen werden.
Phenol
Ortho, für und Torangriffe
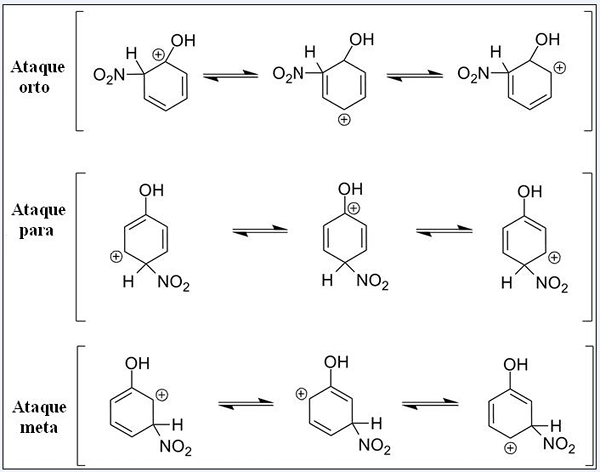 Resonanzstrukturen für Phenol in seiner aromatischen elektrophilen Substitutionsreaktion. Quelle: Pete Davis, Public Domain, über Wikimedia Commons
Resonanzstrukturen für Phenol in seiner aromatischen elektrophilen Substitutionsreaktion. Quelle: Pete Davis, Public Domain, über Wikimedia Commons Betrachten Sie jetzt den Sear für das Fenol. Diesmal ist die Elektrophie das nitronianische Kation, nicht2+, Was beim Verknüpfung mit dem Benzolring in die Nitro -Gruppe umgewandelt wird, nein2.
Kann Ihnen dienen: Nitrate: Eigenschaften, Struktur, Nomenklatur, SchulungJetzt, da eine OH -Gruppe vorhanden ist, hören die anderen Hydrogene auf, chemisch äquivalent zu sein. Einige sind anfälliger für ersetztes als andere. Und außerdem übt OH an diesem Punkt einen direkten Einfluss aus.
Up haben drei Substitutionen in verschiedenen Positionen im Zusammenhang mit OH: Ortho -Angriffen, für und Ziel. Beachten Sie, dass wir in allen drei das sandige Kation und seine Resonanzstrukturen haben. Bei den Ortho -Angriffen und für die positive Belastung im Benzolring befindet sich direkt im mit OH verbundenen Kohlenstoff; Während des Zielangriffs geschieht dies nicht.
Oh als Ortho -Gruppe und als Regisseur
OH bietet die Fähigkeit, durch Resonanz und Induktion Elektronen zum Ring zu bringen. In beiden Fällen kann es dazu beitragen. Im Gegenteil, wenn der Zielangriff auftritt, kann OH die positive Last nicht auf die gleiche Weise stabilisieren, wobei die Struktur instabiler ist.
Daher ortho -Angriffe und für mehr Energie bevorzugt. Es wird dann gesagt, dass OH eine Ortho-für Director-Gruppe ist, die auch den Benzener Ring in Richtung Sear aktivieren kann. Das heißt, das Phenol reagiert viel schneller als Benzol, was durch Messung der Reaktionsgeschwindigkeiten demonstriert wird.
Arilamine
 Resonanzstrukturen für Anilin in seiner aromatischen elektrophilen Substitutionsreaktion. Quelle: V8RIK bei English Wikipedia, CC BY-SA 3.0, über Wikimedia Commons
Resonanzstrukturen für Anilin in seiner aromatischen elektrophilen Substitutionsreaktion. Quelle: V8RIK bei English Wikipedia, CC BY-SA 3.0, über Wikimedia Commons Der Fall der Arilamine, wie der von Anilin (überlegenes Bild), ähnelt dem von Phenol. Beachten Sie, dass diesmal in seinem Mechanismus die Stabilisierung der positiven Belastung des Stickstoffatoms (H2N+=), damit die Substitution hilft, sich auf Ortho -Positionen auszuziehen und wie bei der OH.
Es kann Ihnen dienen: Säure-Bass-Theorien: Arrhenius, Bronsted-Lowry, LewisJetzt ist Anilin reaktiver als Phenol gegen den elektrophilen Substitution. Weil? Weil das Stickstoffatom weniger elektronegativ ist als das von Sauerstoff, weshalb es seinen freien Elektronenpaar leichter für den aromatischen Ring verleiht. Sauerstoff, weil er elektronegativer ist, liefert eines seiner Elektronenpaare mit weniger "Avidität".
Auch der Atomradius des Stickstoffs ist näher an der von Kohlenstoff an der Größe. Dies wirkt sich auf die Tatsache aus. Daher ist die Resonanz zwischen Kohlenstoff und Stickstoff etwas stabiler und effizienter als die zwischen Kohlenstoff und Sauerstoff.
Chlobenzol
In Chlorobenzol hingegen verlangsamt das Atom von CL die Substitution aufgrund seiner Elektronegativität. Und obwohl es auch in der Lage ist, Elektronen aufgrund von Resonanz zum Ring zu spenden.
Als Reaktion darauf reagiert Chlobenzol 50 -mal langsamer als Benzol, da sein Ring aufgrund von Chlor deaktiviert ist. Chlor ist auch eine Zielgruppe.
Verweise
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. (10th Auflage.). Wiley Plus.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Morrison und Boyd. (1987). Organische Chemie. (Fünfte Ausgabe). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Aromatische Verbindung. Abgerufen von: in.Wikipedia.Org
- Edvz et al. (8. September 2020). Aromatische Kohlenwasserstoffe. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Wyman Elizabeth. (2020). Aromatische Kohlenwasserstoffe: Definition, Beispiel und Verwendung. Lernen. Erholt von: Studium.com
- Boluda, c. J., Macías, m., & González Marrero, J. (2019). Die chemische Komplexität des Automobilbenzins. Wissenschaft, Ingenieurwesen und Anwendungen,2(2), 51-79. Doi: doi.org/10.22206/Cyap.2019.V2i2.PP51-79
- « Wärmeenergieeigenschaften, erhalten, übertragen, übertragen
- Aluminiumoxidstruktur, Eigenschaften, Verwendungen, Nomenklatur »

