Aromatische nukleophile Substitutionseffekte, Beispiele
- 2180
- 568
- Joy Hort
Der Aromatische nukleophile Substitution (Snar) ist eine Reaktion, die in der organischen Chemie auftritt, die in der Vertreibung einer guten ausgehenden Gruppe durch ein eingehendes Nucleophil besteht. Aus Sicht seines Mechanismus und seiner elektronischen Aspekte ist es die entgegengesetzte Gesicht der aromatischen elektrophilen Substitution (Sear).
Im Allgemeinen ist die ausgehende Gruppe ein Halogen, das als Haluro X Anion herauskommt-. Diese Reaktion kann nur stattfinden, wenn der aromatische Ring (meist Benzol) an Elektronen mangelhaft ist. Das heißt, wenn Sie Elektronen -Attraktoren -Substituentengruppen haben.
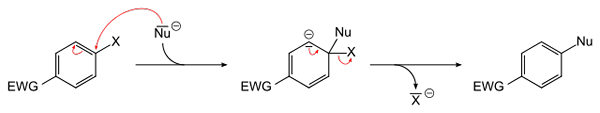
 Allgemeine Gleichung für eine aromatische nukleophile Substitution. Quelle: Sponk [Public Domain]
Allgemeine Gleichung für eine aromatische nukleophile Substitution. Quelle: Sponk [Public Domain] Das überlegene Bild schematisiert das, was im vorherigen Absatz gesagt wurde. Die EWG Electron Attractor Group (für ihr Akronym in Englisch: Elektronenteilungsgruppe), aktiviert den aromatischen Ring für den nukleophilen Angriff der negativen Nu -Spezies-. Es ist ersichtlich, dass ein Vermittler (in der Mitte) gebildet wird, aus dem der Haluro X freigesetzt oder freigegeben wird-.
Beachten Sie, dass es in einfachen X -Begriffen durch Nu in einem aromatischen Ring ersetzt wird. Diese Reaktion ist sehr vielseitig und notwendig bei der Synthese neuer Arzneimittel sowie in Studien zur synthetischen organischen Chemie.
[TOC]
Allgemeine Merkmale
Der aromatische Ring kann von Elektronen "geladen" oder "herunterladen" werden, je nachdem, was ihre Substituenten sind (diejenigen, die den ursprünglichen C-H-Link ersetzen).
Wenn diese Substituenten die elektronische Dichte an den Ring spenden können, wird gesagt, dass sie sie von Elektronen bereichern. Wenn sie im Gegenteil die elektronische Dichte sind (das oben erwähnte EWG), wird dann gesagt, dass sie den Elektronenring verarmten.
In jedem Fall wird der Ring für eine bestimmte aromatische Reaktion aktiviert, während er für den anderen deaktiviert ist.
Zum Beispiel soll ein an Elektronen reichhaltiges aromatisches Ring für aromatische elektrophile Substitution aktiv sein. Das heißt, Sie können Ihre Elektronen an eine Elektrophilatspezies spenden und+. Es wird jedoch keine Elektronen an eine Nu -Art spenden-, Da würden sich negative Gebühren gegenseitig abwehren.
Kann Ihnen dienen: Molekulare OrbitalentheorieWenn der Ring in Elektronen schlecht ist, hat er nicht, wie sie sie der Spezies geben und+ (Sear tritt nicht auf); Stattdessen ist es die Verfügbarkeit, die Elektronen der Nu -Spezies zu akzeptieren- (Snar entwickelt).
Unterschiede bei der aromatischen elektrophilen Substitution
Die allgemeinen Aspekte des Eintritts haben einige Unterschiede zwischen dem Snar und dem Sear aufgeführt:
- Der aromatische Ring wirkt als Elektrophile (schlechte Elektronen) und wird von einem Nucleophil angegriffen.
- Eine ausgehende Gruppe X wird aus dem Ring ersetzt; Kein h+
- Es werden keine Karbokalkationen gebildet, aber Vermittler mit einer negativen Ladung, die durch Resonanz verlagert werden kann
- Das Vorhandensein attraktiverer Gruppen im Ring beschleunigt die Substitution, anstatt sie zu verlangsamen
- Schließlich üben diese Gruppen Direktoren nicht aus, wo (in welchem Kohlenstoff der Kohlenstoff) der Ersatz auftritt. Der Ersatz tritt immer in Kohlenstoff auf, die mit der ausgehenden Gruppe X verbunden sind.
Der letzte Punkt ist auch im Bild dargestellt: Der C-X-Link wird unterbrochen, um den neuen C-Nu-Link zu bilden.
Auswirkungen
Der Anzahl der Substituenten
Natürlich sind die ärmeren Elektronen der Ring, desto schneller ist das Knurren und die am wenigsten drastischen Bedingungen, die für ihn erforderlich sind. Betrachten Sie das folgende Beispiel im unteren Bild:
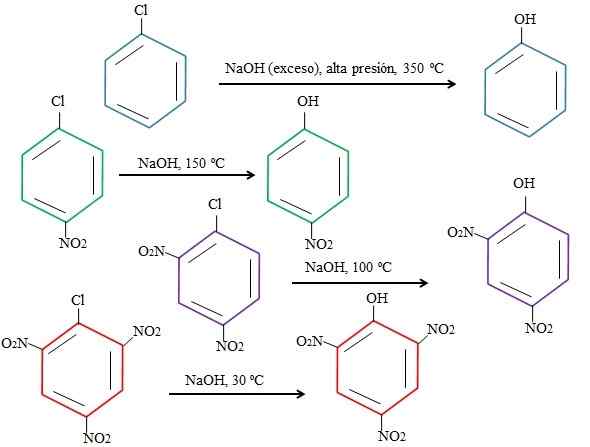 Auswirkungen von Substituenten auf die Substitutionen von 4-NitrocloBenzol. Quelle: Gabriel Bolívar.
Auswirkungen von Substituenten auf die Substitutionen von 4-NitrocloBenzol. Quelle: Gabriel Bolívar. Beachten. In diesem Fall ist Chlor die scheidende Gruppe (CL)-) und das Nucleophilhydroxid (OH-).
Es kann Ihnen dienen: 4 Zeiträume der Chemie: von der Vorgeschichte bis heuteWenn die Gruppe nicht erscheint2, Das ist ein Elektronenatel (grüner Ring), der Substitution kann bei einer Temperatur von 150 ° C beim Umgebungsdruck durchgeführt werden. Mit zunehmender Anzahl der Gruppen nein2 vorhanden (lila und rote Ringe) ersetzt sich der Ersatz bei immer niedrigeren Temperaturen (100 ° C bzw. 30 ° C).
Daher tun Gruppen nicht2 Sie beschleunigen das Knurren und das Unliften von Elektronen zum Ring, was es anfälliger für den Angriff von OH macht-.
Die relativen Positionen des CL werden hier nicht in Bezug auf nicht erklärt2 im 4-NitrocloBenzol und wie sie die Geschwindigkeit der Reaktion verändern; Beispielsweise sind die Reaktionsgeschwindigkeiten des 2-NitrocloCloBenzols und des 3-Nitrochlorbenzols unterschiedlich, wobei letztere im Vergleich zu den anderen Isomeren am langsamsten sind.
Der scheidenden Gruppe
Wenn Sie zum 4-NitrocloCloBenzol zurückkehren, ist seine Substitutionsreaktion langsamer, wenn Sie das Ihres fluorartigen Gegenstücks vergleichen:
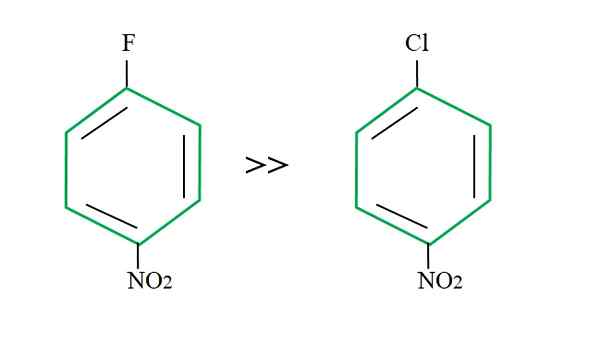 Ausgehend Gruppeneffekt auf Snarreaktionen. Quelle: Gabriel Bolívar.
Ausgehend Gruppeneffekt auf Snarreaktionen. Quelle: Gabriel Bolívar. Die Erklärung davon kann nicht in einer anderen Variablen liegen, dass der Unterschied zwischen f und cl. Fluor ist eine miese ausgehende Gruppe, da der C-F-Link schwieriger zu brechen ist als der C-Cl-Link. Daher ist die Aufschlüsselung dieses Links nicht der bestimmende Schritt der Geschwindigkeit für das Snar- zum aromatischen Ring.
Das Fluor für elektronegativeres als Chlor, Kohlenstoffatom, das mit ihm verbunden ist, hat einen größeren elektronischen Mangel (Cδ+-Fδ-). Infolgedessen wird der Kohlenstoff der C-F-Verbindung von Nu viel wahrscheinlicher angegriffen- als der C-Cl-Link. Deshalb ist der Ersatz von F durch OH viel schneller als der von CL durch OH.
Kann Ihnen dienen: Kupfersulfid: Struktur, Eigenschaften, verwendetBeispiel
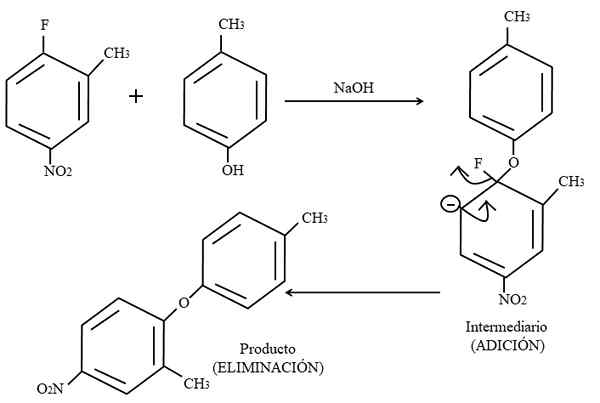 Aromatischer elektrophiler Ersatz. Quelle: Gabriel Bolívar.
Aromatischer elektrophiler Ersatz. Quelle: Gabriel Bolívar. Schließlich ist unten ein Beispiel für diese Art von organischen Reaktionen im höheren Bild gezeigt. Para-Coresol gibt nicht das Aussehen eines Nucleophils; Aber ein grundlegendes Medium ist ungeschützt und hinterlässt ein Phänoxidanion, das das 2-Methyl-4-Nitrofluorzen angreift.
Wenn dieser Angriff auftritt, wird gesagt, dass dem Elektrophilen das Nucleophil zugesetzt wird. Dieser Schritt ist rechts vom Bild zu sehen, wo die Zwischenverbindung mit beiden Substituenten zum Ring gebildet wird.
Durch Hinzufügen von Para-Coresol scheint eine negative Belastung, die Resonanz in den Ring verlagert (Beachten Sie, dass es nicht mehr aromatisch ist).
Im Bild wird die neueste Resonanzstruktur kaum gezeigt, aus der das Fluorid als F beendet ist-; Aber in Wirklichkeit wird diese negative Belastung auch in den Sauerstoffatomen der Gruppe zu Unentschieden2. Nach der Hinzufügung der Eliminierung ist der letzte, wenn das Produkt endgültig gebildet wird.
Abschließender Kommentar
Die Gruppe Nr2 Die verbleibende kann auf die NH -Gruppe reduziert werden2, Und von dort aus ist es möglich, mehr Synthesereaktionen durchzuführen, um das endgültige Molekül zu modifizieren. Dies zeigt das synthetische Potenzial des Knurrens und dass sein Mechanismus zusätzlich aus zwei Schritten besteht: einer der Addition und der Eliminierung.
Derzeit gibt es jedoch experimentelle und rechnerische Beweise dafür, dass in Wirklichkeit die Reaktion nach einem konzertierten Mechanismus erfolgt, bei dem beide Schritte gleichzeitig durch einen aktivierten Komplex und nicht durch einen Zwischenstoffe auftreten.
Verweise
- Morrison, r. T. und Boyd, r, n. (1987). Organische Chemie. 5. Ausgabe. Editorial Addison-Wesley Interamerikaner.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. Amine. (10. Ausgabe.). Wiley Plus.
- Wikipedia. (2019). Nukleophile aromatische Substitution. Abgerufen von: in.Wikipedia.Org
- James Ashenhurst. (6. September 2019). Nukleophile aromatische Substitution (NAS). Erholt von: Masterorganicchemistry.com
- Chemistry Librettexts. (5. Juni 2019). Nukleophile aromatische Substitution. Erholt von: Chem.Librettexts.Org

