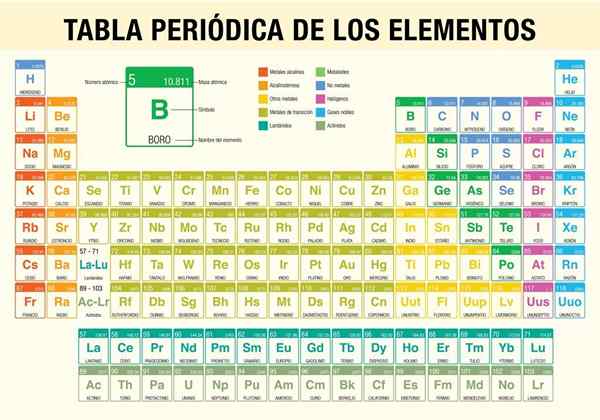
Periodensystem
- 2834
- 65
- Tizian Liebich
Was ist die Periodenzüchttabelle der Elemente??
Der Periodensystem Es ist ein Werkzeug, mit dem Sie die chemischen Eigenschaften der bisher bekannten 118 Elemente konsultieren können. Es ist unverzichtbar bei der Durchführung stöchiometrischer Berechnungen, der Vorhersage der physikalischen Eigenschaften eines Elements, der Klassifizierung und dem Finden regelmäßiger Eigenschaften unter allen von ihnen.
Atome werden schwerer, wenn ihre Kerne Protonen und Neutronen hinzufügen, die auch von neuen Elektronen begleitet werden müssen; Andernfalls wäre die Elektroneuterität nicht möglich. Somit sind einige Atome sehr leicht, wie Wasserstoff und andere, Superpesados, wie z. B. Oganerson.
Es war der Wissenschaftler Dmitri Mendeléyev, der 1869 (vor fast 150 Jahren) nach einem Jahrzehnt theoretischer Studien und Experimente die erste periodische Tabelle veröffentlichte, um die zu diesem Zeitpunkt bekannten 62 Elemente zu organisieren.
Wofür ist der Periodenzüchttisch für?
Die Hauptverwendung der Tabelle sind:
- Kennen Sie das Symbol und den Namen jedes existierenden chemischen Elements.
- Kennen Sie die Atommasse und die Atomzahl des Elements.
- Informieren Sie über die Beziehungen zwischen den verschiedenen Elementen.
- Zeigen Sie die verschiedenen Trends (Periodizität).
- Klassifizierung von Arten chemischer Elemente. Diese Typen umfassen alkalische Metalle, Basismetalle, Übergangsmetalle, Nicht -Metalle, edle Gase, Halogene, alkalische Länder, Halbzeiten, Actiniden und Lanthaniden.
- Vorhersage der Eigenschaften neuer Elemente, die noch nicht entdeckt oder nicht synthetisiert wurden.
Wie ist die Periodenzüchter organisiert?? (Struktur und Organisation)
Perioden
Die Elemente werden in Reihen oder Perioden in Abhängigkeit vom Energieniveau ihrer Orbitale bestellt. Vor Periode 4, als die Elemente in zunehmender Reihenfolge der Atommasse folgten, wurden die chemischen Eigenschaften für alle acht von ihnen erneut wiederholt (Gesetz der Oktaven, von John Newlands).
Übergangsmetalle, die in andere nicht -metallische Elemente wie Schwefel und Phosphor geschlichen wurden. Aus diesem Grund war der Eintritt der Quantenphysik und der elektronischen Konfigurationen für das Verständnis moderner periodischer Tabellen von entscheidender Bedeutung.
Die Orbitale einer Energieschicht sind mit Elektronen (und den Kernen von Protonen und Neutronen) gefüllt, während sie sich über einen Zeitraum bewegt. Diese Energieschicht geht Hand in Hand mit Atomgröße oder Radio; Daher sind die Elemente der höheren Perioden kleiner als die unten gefundenen.
Das H und das Ich habe im ersten (Perioden-) Energieniveau gefunden; die erste Reihe von grauen Kästchen in der vierten Periode; und die Reihe von Ananjadas -Boxen in der sechsten Periode. Beachten Sie, dass, obwohl letzteres in der angeblichen neunten Zeit zu sein scheint, es jedoch tatsächlich zum sechsten gehört, kurz nach der gelben Schachtel von BA.
Gruppen
Eine Periode zu touren ist, dass die Masse, die Anzahl der Protonen und Elektronen zunehmen. In derselben Spalte oder Gruppe, obwohl die Masse und die Protonen variieren, die Anzahl der Anzahl von Valencia -Schichtelektronen ist dasselbe.
Zum Beispiel hat das H in der ersten Spalte oder Gruppe nur ein Elektron im 1S -Orbital1, Wie das li (2s1) Das Natrium (3s1), Kalium (4s1) Und so weiter zum Francio (7s1). Diese Nummer 1 bedeutet, dass diese Elemente kaum ein Valencia -Elektron haben und daher zu Gruppe 1 (AI) gehören. Jedes Element befindet sich in verschiedenen Zeiträumen.
Ohne Wasserstoff zu zählen, grüne Box, stammen die Elemente darunter aus Orangenboxen und werden alkalische Metalle genannt. Noch ein weiterer Zeitraum in jedem Zeitraum ist die Gruppe oder Spalte 2; Das heißt, seine Elemente haben zwei Valenzelektronen.
Kann Ihnen dienen: theoretische LeistungWenn Sie jedoch nach rechts gehen, ohne das Wissen der Orbitale D, erreichen Sie die Gruppe Boro (B) oder Gruppe 13 (IIIa). Anstelle von Gruppe 3 (IIIB) oder Scandio (SC). Unter Berücksichtigung der Füllung der Orbitale D werden die Perioden der grauen Kisten begonnen: die Übergangsmetalle.
Protonenzahlen gegen Elektronen von Valencia
Bei der Untersuchung der Periodenzüchter kann Verwirrung zwischen der Atomzahl Z oder der Anzahl der Gesamtprotonen im Kern und der Menge der Valenzelektronen auftreten. Zum Beispiel hat Carbon ein z = 6, das heißt, er hat sechs Protonen und daher sechs Elektronen (ansonsten könnte es kein Atom mit neutraler Last sein).
Aber von diesen sechs Elektronen, Vier stammen aus Valencia. Aus diesem Grund lautet seine elektronische Konfiguration [er] 2s22 p2. [Er] bezeichnet die beiden Elektronen 1s2 der geschlossenen Schicht und theoretisch nicht an der Bildung chemischer Verbindungen teilnehmen.
Da der Kohlenstoff vier Valenzelektronen hat, befindet sich "bequem" in Gruppe 14 (Mehrwertsteuer) des Periodensystems.
Die Elemente unterhalb des Kohlenstoffs (ja, GE, Sn, Pb und FL) haben mehr höhere atomare (und atomare) Zahlen; Aber jeder hat gemeinsam die vier Elektronen von Valencia. Dies ist der Schlüssel zum Verständnis, warum ein Element einer Gruppe und nicht einer anderen gehört.
Elemente des Periodenzüchters
Blöcke
Wie erläutert, sind die Gruppen 1 und 2 durch ein oder zwei Elektronen in Orbitalen gekennzeichnet. Diese Orbitale sind sphärische Geometrie, und wenn eine dieser Gruppen abstammt, erwerben die Elemente Schichten, die die Größe ihrer Atome erhöhen.
Um starke Trends in ihren chemischen Eigenschaften und Reaktionsweisen zu präsentieren, sind diese Elemente als Block s organisiert. Daher gehören alkalische Metalle und Alkalinerie -Metalle zu diesem Block. Die elektronische Konfiguration der Elemente dieses Blocks beträgt NS (1s, 2s usw.).
Obwohl sich das Heliumelement am oberen rechten Ende der Tabelle befindet, beträgt seine elektronische Konfiguration 1s2 Und gehört daher zu diesem Block.
Block p
Im Gegensatz zu Block S enthalten die Elemente dieses Blocks vollständig volle Orbitale, während ihre P -Orbitale weiterhin mit Elektronen füllen. Die elektronischen Konfigurationen der zu diesem Block gehörenden Elemente sind vom NS -Typ2Np1-6 (P -Orbitale können eine oder bis zu sechs Elektronen zum Füllen haben).
In welchem Teil der Periodenzüchter ist dieser Block also? Rechts: die grünen, Wohn- und blauen Kisten; Das heißt, nicht -metallische Elemente und Schwermetalle wie Wismut (BI) und Blei (PB).
Beginnend mit Bor, mit elektronischer NS -Konfiguration2Np1, Carbon zu Ihrer rechten fügt ein weiteres Elektron hinzu: 2s22 p2. Anschließend sind die elektronischen Konfigurationen der anderen Elemente von Periode 2 von Block P: 2s22 p3 (Stickstoff), 2s22 p4 (Sauerstoff), 2s22 p5 (Fluorid) und 2s22 p6 (Neon).
Wenn die unteren Perioden gesenkt werden, haben die Energieniveau 3: 3s23p1-6, Und so weiter bis zum Ende von Block p.
Beachten Sie, dass das Wichtigste in diesem Block darin besteht, dass seine Elemente aus Periode 4 vollständig Orbitale gefüllt haben (blaue Boxen nach rechts). Zusammenfassend: Der S -Block befindet sich links neben dem Periodenzüchter und Block P nach rechts.
Repräsentative Elemente
Was sind die repräsentativen Elemente? Sie sind diejenigen, die einerseits leicht Elektronen verliert, oder andererseits gewinnen sie sie, um das Oktett von Valencia zu vervollständigen. Mit anderen Worten: Sie sind die Elemente von Blöcken S und P.
Kann Ihnen dienen: Emulgator: Emulsionsprozess, molekulare Aspekte, AnwendungenIhre Gruppen unterschieden sich am Ende durch einen Buchstaben A von anderen. So gab es acht Gruppen: von AI bis viiia. Derzeit ist das in modernen periodische Tabellen verwendete Nummerierungssystem jedoch das Arabisch von 1 bis 18, einschließlich Übergangsmetallen.
Aus diesem Grund kann die Boro -Gruppe der IIIA oder 13 (3+10) sein; die Kohlenstoffgruppe, die Mehrwertsteuer oder 14; und die der edlen Gase, die letzte rechts vom Tisch, viiia oder 18.
Übergangsmetalle
Übergangsmetalle sind alle Elemente der grauen Kisten. Während ihrer gesamten Zeit sind ihre Orbitale gefüllt, die fünf sind und daher zehn Elektronen haben können. Da zehn Elektronen Orbitale ausfüllen müssen, müssen es zehn Gruppen oder Spalten geben.
Jede dieser Gruppen im alten Nummerierungssystem wurde am Ende mit römischen Zahlen und einem Buchstaben B bezeichnet. Die erste Gruppe, die des Skandio, war der IIIB (3), das Eisen, Kobalt und Nickel VIIIB, weil sie sehr ähnliche Reaktivitäten (8, 9 und 10) und die von Zink IIB (12) hatten (12).
Wie zu sehen ist, ist es viel einfacher, Gruppen durch arabische Zahlen zu erkennen, als römische Zahlen zu verwenden.
Interne Übergangsmetalle
Ab Periode 6 des Periodenzüchtertabels beginnen die Orbitale f energetisch verfügbar zu sein. Diese müssen zuerst gefüllt werden als die Orbitale d; Und deshalb werden seine Elemente normalerweise auseinandergesetzt, um den Tisch nicht zu sehr zu verlängern.
Die letzten beiden Perioden, orange und grau. Es gibt sieben Orbitale F, die vierzehn Elektronen zum Füllen benötigen, und daher müssen es vierzehn Gruppen geben.
Wenn diese Gruppen in die Periodenzüchter hinzugefügt werden, gibt es insgesamt 32 (18 + 14) und haben eine „längliche“ Version:
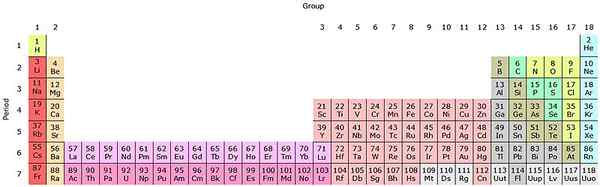 Quelle: von Sandbh [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] aus Wikimedia Commons
Quelle: von Sandbh [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] aus Wikimedia Commons Die klare rosa Reihe entspricht den Lantanoides, während die dunkle rosa Reihe die Actinoide. Der Lantano, das mit z = 57, das Actinio, AC mit Z = 89 und der gesamte Block F gehört zur gleichen Gruppe des Skandio. Weil? Weil der Skandio ein ND -Orbital hat1, die im Rest der Lantanoides und Actinoide vorhanden ist.
Die und AC haben 5D Valencia -Einstellungen16s2 und 6d17s2. Wenn Sie sich direkt auf beiden Zeilen bewegen, beginnen sich 4F- und 5F -Orbitale zu füllen. Sobald Sie voll sind, erreichen Sie die Elemente Luthacio, Lu und Laurencio, LR.
Metalle und Nicht -Metalle
Wenn Sie den Kuchen des Periodensystems hinter sich lassen, ist es bequemer, auf das des überlegenen Bildes zurückzugreifen, auch in seiner länglichen Form. Im Moment waren die überwiegende Mehrheit der oben genannten Elemente Metalle.
Bei Raumtemperatur sind alle Metalle feste Substanzen (außer Quecksilber, flüssig) aus Silbergrau (mit Ausnahme von Kupfer und Gold). Sie sind normalerweise auch hart und brillant; Obwohl die von Block S weich und zerbrechlich sind. Diese Elemente sind durch ihre Leichtigkeit gekennzeichnet, Elektronen zu verlieren und Kationen m zu bilden m+.
Im Falle der Lantanoide verlieren die drei Elektronen 5D16s2 Treide Kationen M3+ (wie sie3+). Der Hügel kann inzwischen vier Elektronen verlieren (CE4+).
Andererseits machen nicht -metallische Elemente den geringsten Teil der Periodenzüchter aus. Sie sind Gase oder Feststoffe mit kovalent verbundenen Atomen (wie Schwefel und Phosphor). Alle befinden sich in Block P; Genauer gesagt erhöht im oberen Teil dessen, wenn es in die unteren Perioden steigt, den metallischen Charakter (Bi, PB, PO).
Zusätzlich gewinnt sie nicht -Metalle, anstatt Elektronen zu verlieren, sie. So bilden sie Anionen x- Mit unterschiedlichen negativen Lasten: -1 für Halogene (Gruppe 17) und -2 für Calcogene (Gruppe 16, Sauerstoff).
Kann Ihnen dienen: Ethylalkohol: Struktur, Eigenschaften, Verwendungen, ErhaltenMetallfamilien
Innerhalb von Metallen gibt es eine interne Klassifizierung, um sie zu unterscheiden:
- Metalle der Gruppe 1 sind alkalisch.
- Gruppe 2, Alkalinererrrior -Metalle (SR. Scholambara).
- Gruppe 3 (IIB) Scandio Familie. Diese Familie besteht aus dem Skandio, dem Gruppenleiter des Ititriums und des Lantano, des Actinio und aller Lantanoides und Actinoides.
- Gruppe 4 (IVB), Titanium Familie: TI, ZR (Circonium), HF (Hafnio) und RF (Rutherfordio). Wie viele Valencia -Elektronen haben? Die Antwort ist in Ihrer Gruppe.
- Gruppe 5 (VB), Vanadio Familie. Gruppe 6 (VIB), Chromfamilie. Und so weiter zur Zinkfamilie, Gruppe 12 (IIB).
Metalloide
Der metallische Charakter nimmt von rechts nach links und von oben nach unten zu. Aber was ist die Grenze zwischen diesen beiden Arten chemischer Elemente? Diese Grenze besteht aus Elementen.
Metalloide sind in der Periodenzüchtertisch in der „Treppe“ zu sehen, die mit Bor beginnt und endet im astato radioaktiven Element. Diese Elemente sind:
- B: Boro.
- Silizium: Ja.
- GE: Germanio.
- AS: Arsen.
- SB: Antimon.
- TE: Telurio.
- AT: Astato.
Jedes dieser sieben Elemente zeigt Zwischeneigenschaften, die je nach chemischer Umgebung oder Temperatur variieren. Eine dieser Eigenschaften ist die Halbwirkung, dh Metalloide sind Halbleiter.
Gase
Unter terrestrischen Bedingungen sind gasförmige Elemente jene nicht licht. Auch Chlor-, Wasserstoff- und Edelgase treten in diese Klassifizierung ein. Von allen von ihnen sind die emblematischsten die edlen Gase, für ihre geringe Tendenz, sich wie freie Atome zu reagieren und sich zu verhalten.
Letzteres befindet sich in Gruppe 18 des Periodensystems und ist:
- Helio, er.
- Neon, ne.
- Argon, ar.
- Kripton, Kr.
- Xenón, Xe.
- Radón, Rn.
- Und das jüngste von allen, das edle synthetische Oganesegas, OG.
Alle edlen Gase haben gemeinsam die Valencia NS -Konfiguration2Np6; Das heißt, sie haben das Oktett von Valencia abgeschlossen.
Aggregationszustände zu anderen Temperaturen
Die Elemente sind je nach Temperatur und Stärke ihrer Wechselwirkungen in festen, flüssigen oder gasförmigen Zustand. Wenn die Erdtemperatur abkühlt, bis die absolute Null (0K) herum ist, würden alle Elemente gefrieren; Außer Helium, das kondensieren würde.
Bei dieser extremen Temperatur wäre der Rest der Gase in Form von Eis.
Im anderen Extrem, wenn die Temperatur ungefähr 6000 k betrug, wären "alle" die Elemente in einem gasförmigen Zustand. Unter diesen Bedingungen konnten Wolken aus Gold, Silber, Blei und anderen Metallen buchstäblich beobachtet werden.
Bedeutung des Periodensabschieds
Derzeit ist die Periodenzüchtertabelle aufgrund der detaillierten Beziehungen ihrer Elemente das wichtigste Organisationsinstrument der Chemie. Seine Verwendung ist sowohl für Schüler als auch für Lehrer sowie für Forscher und viele Fachkräfte, die sich der Zweigstelle für Chemie und Ingenieurwesen widmen.
Wenn Sie sich nur die Periodenzüchter ansehen, werden eine immense Menge und Informationen schnell und effektiv erhalten, wie beispielsweise:
- Lithium (Li), Beryllium (BE) und Bor (B) leiten Strom leiten.
- Lithium ist ein alkalisches Metall, Beryllium ist ein Alkalin -andere Metall und Bor ist kein Metall.
- Lithium ist der beste Treiber der drei genannten, gefolgt von Beryllium und schließlich Boron (Halbleiter).
Durch die Lokalisierung dieser Elemente in der Periodenzüchtertabelle kann seine Tendenz zur elektrischen Leitfähigkeit sofort abgeschlossen werden.