Geschichte der molekularen kinetischen Theorie, Postulate und Beispiele

- 2905
- 503
- Ivan Pressler
Der Molekulare kinetische Theorie Es ist eines, das versucht, die experimentellen Beobachtungen von Gasen aus mikroskopischer Perspektive zu erklären. Das heißt, es versucht, die Natur und das Verhalten von gasförmigen Partikeln mit den physikalischen Eigenschaften von Gas als Flüssigkeit zu verbinden. Erklären Sie das Makroskop aus dem mikroskopischen.
Gase waren aufgrund ihrer Eigenschaften immer Gegenstand von Interesse für Wissenschaftler. Sie belegen das gesamte Volumen des Behälters, in dem sie sind, und können in der Lage sein, vollständig zu komprimieren, ohne dass ihr Inhalt dem niedrigeren Widerstand widerspricht. Und wenn die Temperatur zunimmt, erweitert sich der Behälter und kann sogar knacken.
 Gaspartikel unter entfernten Bedingungen oder nahe der Verflüssigung. Quelle: Olivier Cleynen und Benutzer: Sharayanan [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Gaspartikel unter entfernten Bedingungen oder nahe der Verflüssigung. Quelle: Olivier Cleynen und Benutzer: Sharayanan [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Viele dieser Eigenschaften und Verhaltensweisen werden in den Gesetzen idealer Gase zusammengefasst. Sie betrachten jedoch Gas als Ganzes und nicht als eine Reihe von Millionen dispergierter Partikel im Weltraum; Darüber hinaus liefert es keine Informationen zur Bewegung dieser Partikel aus Druck-, Volumen- und Temperaturdaten, wie sich diese Partikel bewegen.
Es ist so, dass die molekulare kinetische Theorie (TCM) vorschlägt, sie als mobile Kugeln zu visualisieren (überlegenes Bild). Diese Kugeln kollidieren miteinander und die Wände willkürlich und halten eine lineare Flugbahn bei. Wenn jedoch die Temperatur abnimmt und der Druck zunimmt, wird die Flugbahn der Kugeln zu Kurve.
Ein Gas muss laut TCM sich wie die Kugeln des ersten Bildboxs verhalten. Aber wenn sie abgekühlt sind und den Druck auf sie erhöhen, bewegt sich ihr Verhalten vom Ideal weg. Sie sind dann echte Gase, nahe der Verflüssigung und gehen in die flüssige Phase.
Unter diesen Bedingungen werden die Wechselwirkungen zwischen den Kugeln wichtiger, bis zu dem Punkt, dass sich ihre Geschwindigkeiten momentan langsam verlangsamen. Je näher sie aus der Verflüssigung sind, desto mehr Kurven sind ihre Flugbahnen (rechter Kasten) und ihre Kollisionen sind weniger Energie.
[TOC]
Geschichte
Daniel Bernoulli
Die Idee dieser Kugeln, besser als Atome bezeichnet, war bereits vom römischen Philosoph Lucretius betrachtet worden; Nicht für Gase, sondern für feste, statische Objekte. Andererseits wandte Daniel Bernoulli 1738 die atomare Sicht auf Gase und Flüssigkeiten an, indem er sie sich als ungeordnete Kugeln in alle Richtungen vorstellte.
Seine Arbeit verstieß jedoch gegen die Gesetze der Physik zu dieser Zeit; Ein Körper konnte sich nicht ewig bewegen, daher war es unmöglich zu glauben, dass eine Reihe von Atomen und Molekülen ohne Verlust ihrer Energie miteinander kollidierten; Das heißt, die Existenz elastischer Kollisionen war nicht möglich.
Rudolf Clausius
Ein Jahrhundert später verstärkten andere Autoren das TCM mit einem Modell, bei dem sich Gaspartikel in eine Richtung bewegten. Rudolf Clausius hat jedoch seine Ergebnisse zusammengestellt und ein vollständigeres Modell des TCM bewaffnet, mit dem es die idealen Gase -Gesetze von Boyle, Charles, Dalton und Avogadro erklären wollte.
Kann Ihnen dienen: Coulombimetrie: Grundlagen, Typen, AnwendungenJames Clerk Maxwell und Ludwig Boltzmann
Im Jahr 1859 erklärte James Clerk Maxwell, dass gasförmige Partikel bei einer bestimmten Temperatur einen Geschwindigkeitsbereich aufweisen und dass ein Satz von ihnen mithilfe einer durchschnittlichen Molekulargeschwindigkeit berücksichtigt werden kann.
1871 verband Ludwig Boltzmann 1871 vorhandene Ideen mit Entropie und wie thermodynamisch immer den maximal möglichen Raum auf homogene und spontane Weise einnimmt.
Postulierte molekulare kinetische Theorie
Gas aus seinen Partikeln zu berücksichtigen, ein Modell, in dem bestimmte Postulate oder Annahmen erfüllt sind; postuliert, dass logisch in der Lage sein sollte, die makroskopischen und experimentellen Beobachtungen vorherzusagen und zu erklären (so treu wie möglich). Trotzdem werden die Postulate des TCM erwähnt und beschrieben.
Das Volumen der gasförmigen Partikel ist vernachlässigbar
In einem Behälter voller Gaspartikel zerstreuen sie sich und bewegen sich zwischen ihnen durch alle Ecken. Wenn sie sich für einen Moment ohne Verflüssigung an einem bestimmten Punkt des Behälters treffen könnten.
Dies bedeutet, dass im Behälter, auch wenn es Millionen von gasförmigen Partikeln enthält, wirklich leer als voller ist (Volumen-Vacío-Verhältnis viel weniger als 1); Wenn seine Barrieren dies zulassen, können er und Gas im Inneren abrupt komprimiert werden; Da sind die Partikel sehr klein, genau wie ihr Volumen.
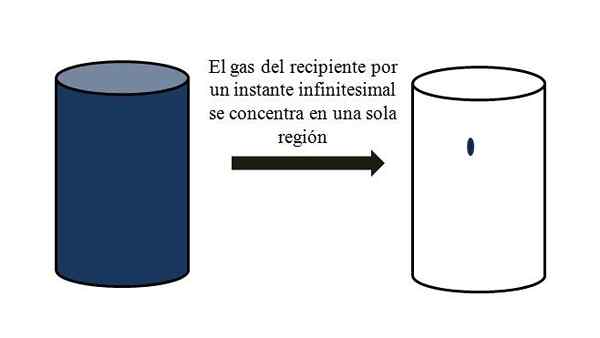 Volumen-Vacío-Beziehung eines Gases in einem Behälter. Quelle: Gabriel Bolívar.
Volumen-Vacío-Beziehung eines Gases in einem Behälter. Quelle: Gabriel Bolívar. Das überlegene Bild zeigt genau das, was oben kommentiert wird, mit einem bläulichen Gas.
Die Anziehungskräfte zwischen den Partikeln sind null
Gasförmige Partikel im Behälter kollidieren miteinander ohne ausreichende Zeit, damit ihre Wechselwirkungen Stärke werden; Noch weniger, wenn das, was sie hauptsächlich umgibt, molekular leer ist. Eine unmittelbare Folge davon ist, dass ihre linearen Trajektorien es ihnen ermöglichen, das Volumen des Containers vollständig abzudecken.
Wenn dies nicht der Fall wäre, hätte ein "bizarrer" und "labyrinthischer" Behälter aufgrund von Gaskondensation feuchte Regionen; Stattdessen reisen die Partikel den gesamten Behälter mit voller Freiheit, ohne die Stärke ihrer Interaktionen, die sie stoppen.
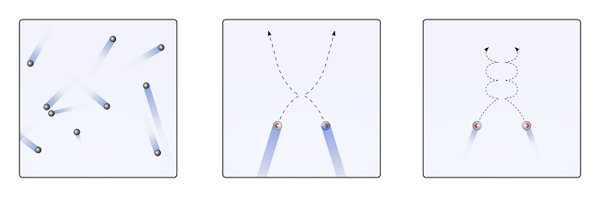
Kann Ihnen dienen: Chlorsäure (HCLO3) Entsorgt von gasförmigen Partikeln, wenn die Wechselwirkungen null oder unbedeutend sind (zu., linear) und wenn sie wichtig sind (b)., Kurven). Quelle: Gabriel Bolívar.
Entsorgt von gasförmigen Partikeln, wenn die Wechselwirkungen null oder unbedeutend sind (zu., linear) und wenn sie wichtig sind (b)., Kurven). Quelle: Gabriel Bolívar. Die linearen Trajektorien des oberen Bildes (a.) Demonstrieren Sie dieses Postulat; Während wenn die Flugbahnen Kurven sind (b).), Beweise dafür, dass es Wechselwirkungen gibt, die zwischen den Partikeln nicht ignoriert werden können.
Gaspartikel sind immer in Bewegung
Von den ersten beiden Postulaten konvergieren zusätzlich die Tatsache, dass Gaspartikel nie aufhören, sich zu bewegen. Sobald sie im Behälter verschwommen waren, kollidieren sie miteinander und mit den gleichen Wänden, wobei eine Kraft und Geschwindigkeit direkt proportional zur absoluten Temperatur; Diese Kraft ist der Druck.
Wenn die gasförmigen Partikel aufhören, sich einen Moment zu bewegen, würde dies in den „Rauchsprachen“ beobachtet, die aus dem Nichts entstehen, mit genügend Zeit, um sich in einem Vakuum zu bestellen und zufällige Wege zu geben.
Die Kollisionen zwischen den Partikeln und den Wänden des Behälters sind elastisch
Wenn die elastischen Kollisionen zwischen den gasförmigen Partikeln und den Wänden des Behälters niemals im Behälter auftreten, tritt sie niemals auf (während die physikalischen Bedingungen nicht ändert) die Kondensation des Gases; Oder was ist das Gleiche wie zu sagen, dass sie sich nie ausruhen und immer kollidieren.
Dies liegt daran, dass bei elastischen Kollisionen kein Nettoverlust der kinetischen Energie vorliegt. Ein Partikel kollidiert mit der Wand und springt mit der gleichen Geschwindigkeit. Wenn ein Teilchen bei der Kollision die Geschwindigkeit verringert, beschleunigt sich die anderen, ohne Wärme oder Schall, die die kinetische Energie von ihnen löst.
Kinetische Energie bleibt nicht konstant
Die Bewegung der Partikel ist zufällig und chaotisch, so dass nicht alle die gleiche Geschwindigkeit tragen; Wie zum Beispiel auf einer Autobahn oder in einer Menge. Einige sind energischer und reisen mehr Geschwindigkeit, während andere langsam sind und auf eine Kollision warten, um sie zu beschleunigen.
Um Ihre Geschwindigkeit zu beschreiben, muss dann einen Durchschnitt berechnet werden. Und damit wird die durchschnittliche kinetische Energie der Partikel oder Gasmoleküle erhalten. Da sich die kinetische Energie aller Partikel ständig ändert, ermöglicht der Durchschnitt eine bessere Datenkontrolle und Sie können mit größerer Zuverlässigkeit arbeiten.
Die durchschnittliche kinetische Energie entspricht einer gegebenen Temperatur für alle Gase
Durchschnittliche molekulare kinetische Energie (ECMP) In einem Behälter wird es mit der Temperatur modifiziert. Bei einer höheren Temperatur wird diese Energie größer sein. Da es ein Durchschnitt ist, kann es Partikel oder Soda geben, die eine größere oder weniger Energie in Bezug auf diesen Wert haben. einige schneller und langsamer.
Können Ihnen dienen: Säuren und Basen: Unterschiede, Eigenschaften, BeispieleMathematisch kann gezeigt werden, dass ECMP Es hängt ausschließlich von der Temperatur ab. Dies bedeutet, dass es keine Rolle spielt, was das Gas, seine molekulare Masse oder Struktur, seine ECMP Es wird bei einer t -Temperatur gleich sein und variiert nur, wenn es zunimmt oder abnimmt. Von allen Postulaten ist dies vielleicht am relevantesten.
Und was ist mit der durchschnittlichen Molekulargeschwindigkeit? Im Gegensatz zu ECMP, Die Molekülmasse beeinflusst die Geschwindigkeit. Je schwerer das Partikel- oder Gasmolekül, es ist natürlich, sich langsamer zu bewegen.
Beispiele
Im Folgenden finden Sie einige kurze Beispiele dafür, wie TCM es geschafft hat, den Gesetzen idealer Gase Erklärungen zu geben. Obwohl sie nicht angesprochen werden, können andere Phänomene wie die Verbreitung und den Erguss von Gasen ebenfalls mit dem TCM erklärt werden.
Boyle Law
Wenn das Volumen des Behälters bei konstanter Temperatur komprimiert ist, nimmt der Abstand, in dem die gasförmigen Partikel kollidieren müssen, um gegen die Wände zu kollidieren. Dies entspricht einer Zunahme der Häufigkeit dieser Kollisionen, was zu einem größeren Druck führt. Wenn die Temperatur konstant ist, ECMP Es ist auch konstant.
Charles Law
Wenn t, erhöht sich ECMP wird steigen. Gasenteilchen bewegen sich schneller und kollidieren eine größere Häufigkeit mit den Wänden des Behälters. erhöht den Druck.
Wenn die Wände flexibel sind und sich ausdehnen können, wird sein Bereich größer und der Druck fällt, bis er konstant wird. Und infolgedessen wird das Volumen ebenfalls zunehmen.
Daltons Gesetz
Wenn mehrere Liter unterschiedliche Gase in einem geräumigen Behälter aus kleineren Behältern zugegeben würden, wäre ihr Gesamtdruck der Summe der Teildrücke, die von jeder Gasart getrennt ausgeübt werden.
Weil? Weil alle Gase miteinander kollidieren und homogen zerstreuen; Die Wechselwirkungen zwischen ihnen sind ungültig und das Vakuum überwiegt im Behälter (postuliert das TCM).
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Learning, S. 426-431.
- Fernández Pablo. (2019). Molekulare kinetische Theorie. Vix. Geborgen von: Vix.com
- Jones, Andrew Zimmerman. (7. Februar 2019). Kinetische Molekültheorie von Gasen. Erholt von: thoughtco.com
- Hall Nancy. (5. Mai 2015). Kinetische Gasentheorie. Glenn Research Center. Abgerufen von: GRC.Topf.Regierung
- Blaber m. & Niedriger s. (9. Oktober 2018). Grundlagen der kinetischen molekularen Theorie. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Die kinetische Molekulartheorie. Abgerufen von: Chemed.Chem.Purdue.Edu
- Wikipedia. (2019). Kinetische Gasentheorie. Abgerufen von: in.Wikipedia.Org
- TOPPR. (S.F.). Kinetische Molekültheorie von Gasen. Erholt von: topppr.com

