Kollisionstheoriesysteme, Energie, Beispiele
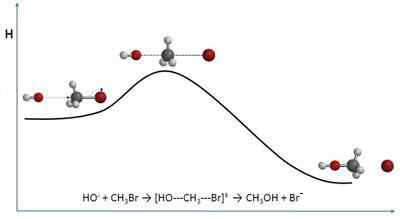
- 1139
- 19
- Frederike Birkemeyer
Der Kollisionstheorie Erklären Sie die Geschwindigkeiten chemischer Reaktionen aus lediglich molekularer Perspektive. Es ist daher eng nahe der chemischen Kinetik. Anstatt sich in Bezug auf die Konzentrationen Geschwindigkeiten zu nähern, basiert dies auf Kollisionsfrequenzen.
Wenn Sie über Kollisionen sprechen, kann das Image einiger Billardkugeln sich auf den Tisch auswirken. Moleküle, obwohl diese Theorie annimmt, dass ihre Formen sphärisch sind, verhalten sich nicht ähnlich. Molekulare Kollisionen unterscheiden sich in verschiedenen Arten sowohl räumlich als auch Energie.

Obwohl diese Theorie mathematisch etwas komplex sein kann und beträchtliche Unterschiede in Bezug auf experimentelle Ergebnisse aufweist, bietet sie ein Bild sichtbarer Interpretationen und ohne abstrakte Aspekte.
Obwohl es für gasförmige Systeme oder sehr verdünnte Lösungen angewendet wird, können sich seine Prinzipien auf jede Reaktion und jedes physikalische Medium erstrecken.
[TOC]
Auftreten von Reaktionen für Reaktionen
Nach der Kollisionstheorie gibt es drei Bedingungen für Reaktionen:
- Chemische Spezies (Ionen, Moleküle, Radikale usw.) Sie müssen effizient kollidieren.
- Sie müssen genug Energie für den Zusammenbruch ihrer Verbindungen tragen.
- Darüber hinaus muss die Aufprallorientierung sehr spezifisch sein.
Molekulare Kollisionen
 Wie beim Bowling finden Reaktionen nur statt, wenn effiziente Kollisionen in Bezug auf Energie und Führung auftreten
Wie beim Bowling finden Reaktionen nur statt, wenn effiziente Kollisionen in Bezug auf Energie und Führung auftreten Molekulare Kollisionen haben etwas gemeinsam mit makroskopisch: Sie treten überwiegend zwischen zwei Arten oder Körpern auf. Zwei Billardkugeln kollidieren miteinander sowie einen Fußballball gegen eine Wand oder zwei Projektile in der Mitte der Luft. Das heißt, Kollisionen in Bezug auf die Chemie und ihre Reaktionen sind in der Regel bimolekularer Typ.
Kann Ihnen dienen: Ionisation in Physik und Chemie: Konzept, Prozess und BeispieleDie Moleküle sind noch nicht still, aber sie bewegen sich und drehen sich durch den Raum, der sie umgibt. Dabei wird angenommen, dass sie eine Art Kreis namens Querschnitt ziehen, auf dem die Wahrscheinlichkeit ein anderes Säulenmolekül ist. Ebenso berücksichtigt die Theorie, dass Moleküle kugelförmig sind, um mathematische Modelle zu vereinfachen.
Zwei hypothetisch kugelförmige Moleküle können ohne Probleme kollidieren, auch wenn es keine chemische Reaktion gibt. Aber es passiert nicht auf die gleiche Weise, wenn es um drei, vier oder mehr Moleküle geht.
Je mehr Arten sie kollidieren sollten, um ein Produkt zu studieren, desto unwahrscheinlicher wird das Phänomen. Dies wird visuell erklärt, dass drei Bälle oder Projektile gleichzeitig zusammen kollidieren. Daher sind bimolekulare Kollisionen bei weitem die häufigsten.
Systeme
Die Kollisionstheorie gilt nur für Softwaresysteme oder Phasen. Dies liegt daran, dass Gase ein Verhalten zeigen, das durch ihre Kinetik gut beschrieben werden kann.
Für flüssige Phasen oder sehr verdünnte Lösungen werden reaktive Spezies in einen Lösungsmittelmolekülenkäfig eingewickelt, mit dem sie auch kollidieren. Dies modifiziert das Panorama, da die Reaktionen nicht nur von den Frequenzen der Kollisionen abhängen, sondern auch von der Diffusion der Reaktantenmoleküle durch das Medium.
Kollisionsenergien
Die Moleküle können langsam oder sehr schnell kollidieren. Dies hängt davon ab, wie groß seine Energie, was wiederum mit der Temperatur erheblich variiert. Je stärker die Kollision ist, desto der Wahrscheinlichkeit, dass eine chemische Reaktion besteht.
Kann Ihnen dienen: MonomereDiese Energie wird als Aktivierung bekannt, undZU, Und es ist charakteristisch für jede chemische Reaktion. Wenn die Temperatur zunimmtZU, Die Anzahl der effektiven Kollisionen und damit die gebildeten Produkte erhöhen sich also.
In Gegenwart eines Katalysators undZU nimmt ab, da es Oberflächen bietet und elektronische bedeutet, dass Kollisionen zugute kommen. Das Ergebnis: Die Reaktionsgeschwindigkeit nimmt zu, ohne die Temperatur zu erhöhen oder andere Reagenzien hinzuzufügen.
Sterischer Faktor
Chemische Spezies kollidieren effektiv, um zu reagieren und diese Theorie vorherzusagen, was die Geschwindigkeit ihrer Reaktionen sein wird. Experimente haben jedoch gezeigt, dass je komplexer die Strukturen der Reagenzien sind, desto größer die Abweichungen oder Unterschiede zwischen den theoretischen und experimentellen Geschwindigkeiten.
Dies liegt daran, dass die Moleküle alles andere als kugelförmig sind, aber räumlich alle Arten von Geometrien haben. Hier tritt der sterische Faktor ein, ρ, mit dem es versucht, die Reaktionsgeschwindigkeiten so zu korrigieren, dass die Vorhersagen der Theorie mit den experimentellen Ergebnissen besser sind.
Beispiele für Reaktionen
Bimolekulare Reaktion
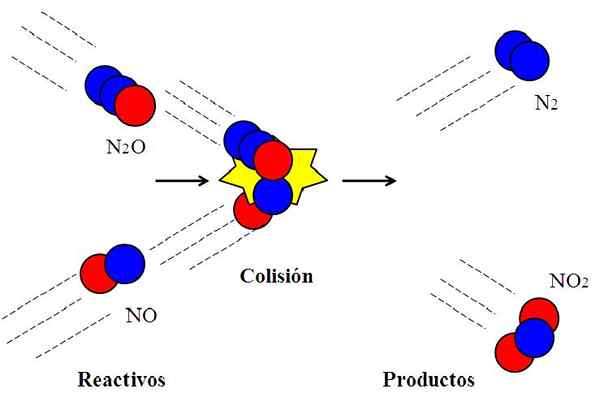 Wirksame Kollision zwischen Stickstoffoxiden. Quelle: Gabriel Bolívar.
Wirksame Kollision zwischen Stickstoffoxiden. Quelle: Gabriel Bolívar. Die folgende Reaktion:
N2O + nein → n2 + NEIN2
Es wird häufig verwendet, um zu erklären, was wirksame Orientierung bei molekularen Kollisionen bedeutet.
Das Molekül n2Oder Dyitrogenoxid reagiert es nicht mit dem Nr. Stickoxid, es sei denn, während der Kollision ist das Sauerstoffatom (roter Kreis) des n2Oder schockieren direkt mit dem Stickstoffatom (blauer Kreis) des NO. Nur so wird die Produkte n entstehen2 und nicht2; Ansonsten n Moleküle2O und sie werden nicht springen, ohne zu reagieren.
Kann Ihnen dienen: gasöser Zustand: Merkmale, allgemeines Recht, BeispieleDies ist ein Beispiel für eine bimolekulare Kollision für eine elementare bimolekulare Reaktion. Selbst wenn Reagenzien über genügend Energie verfügen, um die Verbindungen zu brechen, gibt es keine chemische Reaktion, wenn die Ausrichtung nicht angemessen ist.
Unimolekulare Reaktion
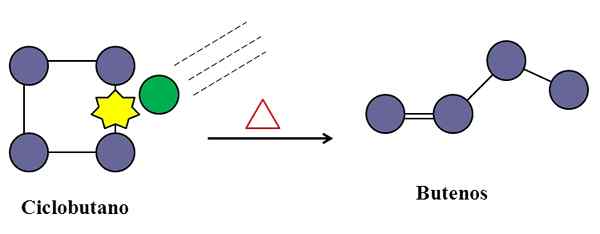 Kollisionen sind auch für die Cyclobutan -Isomerisierung unverzichtbar. Quelle: Gabriel Bolívar.
Kollisionen sind auch für die Cyclobutan -Isomerisierung unverzichtbar. Quelle: Gabriel Bolívar. In einer unimolekularen elementaren Reaktion können molekulare Kollisionen auch eingreifen, auch wenn es sich nur um eine Spezies handelt.
Betrachten Sie zum Beispiel die Isomerisierung des Cyclobutan. Wenn die Temperatur zunimmt, vibriert Cyclobutanmoleküle bei höheren Frequenzen und kollid. Die Produkte zeigen jedoch, dass zwei Cyclobutanmoleküle nicht aufeinander reagieren, da sie sonst eine Verbindung mit acht Kohlenstücken produzieren würden.
In der Mitte kann es Verunreinigungen (grüner Kreis) geben, die auch mit dem Cyclobutan kollidieren, insbesondere auf einer seiner C-C-Verbindungen. Dies können edle Gase oder nicht sehr reaktive Moleküle wie Stickstoff sein.
Es wird eine Zeit kommen, in der Verunreinigung mit ausreichender Energie kollidiert wird, um eine der C-C-Verbindungen des Cyclobutans zu brechen. Und dann wird sein Molekül versuchen, ein Butene neu zu ordnen und zu entstehen, das für seine Doppelbindung und seine lineare Kettenstruktur erkennbar ist.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Glasstone. (1970). Physikochemievertrag. Aguilar s. ZU. von Ausgaben, Juan Bravo, 38, Madrid (Spanien).
- Walter J. Moore. (1962). Physikalische Chemie. (Vierte Edition). Longmans.
- Wikipedia. (2020). Kollisionstheorie. Abgerufen von: in.Wikipedia.Org
- Die Herausgeber von Enyclopaedia Britannica. (2020). Kollisionstheorie. Britannica Encyclopaedia. Erholt von: Britannica.com
- Clark Jim. (2018). Die Koloritätstheorie der Reaktionsraten. Erholt von: Chemguide.CO.Vereinigtes Königreich
- Lawson p. & Niedriger s. (18. Mai 2020). Die Colisionstheorie. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- « Didaktische Texteigenschaften, Struktur, Typen und Beispiele
- Insular America oder Antilles -Länder und Merkmale »

