Sea Theory of Electrons Fundamentals und Eigenschaften
- 5058
- 1389
- Frederike Birkemeyer
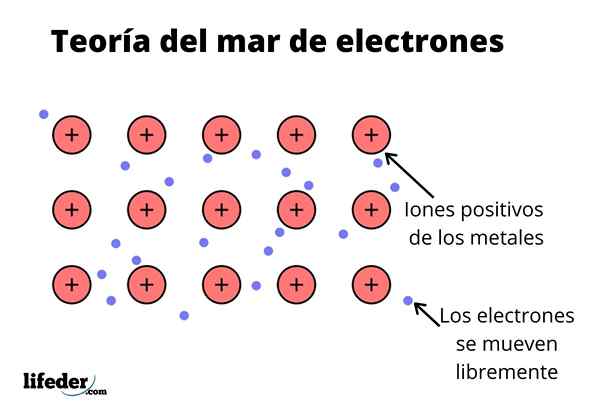
Der Elektronenmeetheorie Es ist eine Hypothese, die ein außergewöhnliches chemisches Phänomen erklärt, das in Metallbindungen zwischen Elementen mit niedrigen Elektronegativitäten auftritt. Dies ist das Teilen von Elektronen zwischen verschiedenen Vereinigten Atomen durch Metallbindungen.
Die elektronische Dichte zwischen diesen Bindungen ist so, dass die Elektronen umgesiedelt werden und ein "Meer" bilden, wo sie sich frei bewegen. Es kann auch durch Quantenmechanik ausgedrückt werden: Einige Elektronen (es gibt normalerweise ein bis sieben pro Atom) sind in Orbitalen mit mehreren Zentren angeordnet, die von der metallischen Oberfläche gedehnt werden.
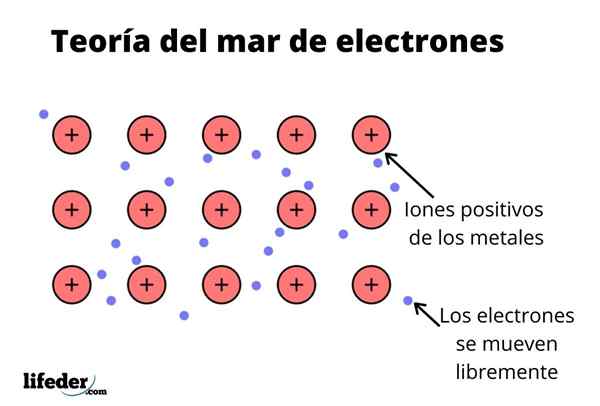
Elektronen behalten auch einen gewissen Standort im Metall, obwohl die Wahrscheinlichkeitsverteilung der elektronischen Wolke eine größere Dichte um einige bestimmte Atome aufweist. Dies liegt daran.
[TOC]
Grundlagen der Elektronseetheorie
Metallelemente haben eine große Tendenz, Elektronen ihres neuesten Energieniveaus (Valenzschicht) aufgrund ihrer niedrigen Ionisationsenergie in Bezug auf die anderen Elemente zu spenden.
Wenn jedes metallische Element dies wissen, kann es als ein Kation angesehen werden, das mit dem Elektron seines letzten Energieniveaus verbunden ist, was anfällig für Spenden wäre.
Wie in einem Metall gibt es eine große Anzahl von Atomen, die miteinander verbunden sind, kann angenommen werden, dass dieses Metall eine Gruppe von Metallkationen bildet.
In Anbetracht dessen, dass die elektrostatischen Anziehungskräfte zwischen dem Kation (positive Belastung) und dem Elektron (negative Belastung) die Atome des Metalls stark miteinander verbunden haben.
Kann Ihnen dienen: PolymereAuf diese Weise kann abgeleitet werden, dass diese Art von elektrostatischer Klebstoff eine größere Festigkeit hat, je größer die Anzahl der in der Valencia -Schicht vorhandenen Elektronen vorhanden ist.
Eigenschaften
Die Theorie der Elektronsee bietet eine einfache Erklärung für die Eigenschaften von Metallarten wie Widerstand, Leitfähigkeit, Duktilität und Formbarkeit, die von einem Metall zum anderen variieren.
Es wurde festgestellt.
Auf diese Weise wird Duktilität als die Fähigkeit bestimmter Materialien bezeichnet, die Verformung ihrer Struktur zu ermöglichen, ohne genug zu geben, um zu brechen, wenn sie bestimmten Kräften ausgesetzt sind.
Delokalisierung in Form von Schichten
Sowohl die Duktilität als auch die Formbarkeit eines Metalls werden durch die Tatsache bestimmt, dass Valencia -Elektronen in Form von Schichten in alle Richtungen Demoziert werden, wodurch sie sich gegenseitig verdrängen lassen seine Verformung.
Ebenso ermöglicht die Bewegungsfreiheit umgezogener Elektronen einen Strom des elektrischen Stroms, was dazu führt, dass Metalle eine sehr gute Stromleitfähigkeit aufweisen.
Darüber hinaus ermöglicht dieses Phänomen der freien Bewegung von Elektronen die Übertragung der kinetischen Energie zwischen den verschiedenen Metallregionen, die die Wärmeübertragung fördern und Metalle zu einer großen thermischen Leitfähigkeit zeigen.
Es kann Ihnen dienen: Jodosesäure (HIO2): Eigenschaften und VerwendungElektronen -Meerentheorie in Metallkristallen
Kristalle sind feste Substanzen mit physikalischen und chemischen Eigenschaften - als Dichte, Schmelzen und Härte -, die durch die Art von Kräften festgelegt werden, die die Partikel machen, die sie umfassen.
In gewisser Weise wird davon ausgegangen.
In diesem Sinne wurde festgestellt, dass die Struktur von Metallkristallen im Allgemeinen kubisch ist und sich auf Gesichter oder Körper konzentriert.
Diese Arten können jedoch auch eine hexagonale Form haben und eine ziemlich kompakte Verpackung haben, die ihnen diese enorme Dichte verleiht, die für sie charakteristisch ist.
Aus diesem strukturellen Grund unterscheiden sich die Verbindungen, die in Metallkristallen gebildet werden, von denen, die in anderen Kristallklassen auftreten. In der gesamten kristallinen Struktur werden zuvor erklärt, dass Elektronen, die Bindungen bilden können, zuvor erklärt werden.

Nachteile der Theorie
Bei Metallatomen gibt es im Verhältnis zu ihrem Energieniveau eine geringe Menge an Valenzelektronen. Das heißt, es gibt eine größere Menge an Energiezuständen als die Menge an verknüpften Elektronen.
Dies impliziert, dass, da es einen starken elektronischen Umzug und auch Energiebänder gibt, die teilweise gefüllt sind, Elektronen durch die retikuläre Struktur bewegen können das Netzwerk.
Kann Ihnen dienen: oxácidoSo wird die Vereinigung von Metallen als Konglomerat positiver Ionen interpretiert, die von einem Meer von Elektronen (negative Belastung) gekoppelt sind (negative Last).
Es gibt jedoch Merkmale, die durch dieses Modell nicht erklärt werden, z. B. die Bildung bestimmter Legierungen zwischen Metallen mit spezifischen Zusammensetzungen oder die Stabilität kollektiver Metallverbindungen.
Diese Unannehmlichkeiten werden durch die Quantenmechanik erklärt, da sowohl diese Theorie als auch viele andere Ansätze auf der Grundlage des einfachsten Modells eines einzelnen Elektrons festgelegt wurden, während er versucht, in viel komplexeren Strukturen multielektronischer Atome anzuwenden.
Verweise
- Wikipedia. (2018). Wikipedia. Abgerufen von.Wikipedia.Org
- Holman, j. S., Und Stein, p. (2001). Chemie. Aus Büchern erholt.Google.CO.gehen
- Parkin, g. (2010). Metall-Metal-Bindung. Aus Büchern erholt.Google.CO.gehen
- Rohrer, g. S. (2001). Struktur und Bindung in kristallinen Materialien. Aus Büchern erholt.Google.CO.gehen
- Ibach, h., und Lüth, h. (2009). Festkörperphysik: Eine Einführung in die Prinzipien der Materialwissenschaft. Aus Büchern erholt.Google.CO.gehen
- « Kultureller Hybridisierungsprozess, Typen und Beispiele
- 20 touristische Orte von Aguascalientes (Fotos) »

