Molekulare Orbitalentheorie

- 3758
- 420
- Luca Holdt
Was ist molekulare Orbitalentheorie?
Der Molekulare Orbitalentheorie (Tom) Es ist ein mathematisches Modell, das entwickelt wurde, um die physikalisch -chemischen Eigenschaften von Molekülen wie Absorption und Emission von Strahlung, elektrische Leitfähigkeit sowie die elektronische Natur seiner Verbindungen zu erklären. Dies berücksichtigt im Gegensatz zur Valencia Link Theory (TEV), dass Elektronen im gesamten Molekül verlegt werden, ohne sich probabilistisch in den Links zu befinden.
Daher wendet die molekulare Orbitalentheorie die gleichen Quantenprinzipien an, die die Wellenfunktionen für Atomorbitale bestimmen und so den Energiezustand von Elektronen in Atomen beschreiben; Erst jetzt befasst sich die sogenannten molekularen Orbitale.
 Der Paramagnetismus des flüssigen Sauerstoffs und damit seine Anziehungskraft für Magnete wird dank der molekularen Orbitalentheorie erklärt. Quelle: Pieter Kuiper über Wikipedia.
Der Paramagnetismus des flüssigen Sauerstoffs und damit seine Anziehungskraft für Magnete wird dank der molekularen Orbitalentheorie erklärt. Quelle: Pieter Kuiper über Wikipedia. Die molekulare Orbitalentheorie wirkt dann und arbeitet dann mit molekularen Orbitalen, ihren elektronischen und räumlichen Verteilungen sowie den Diagrammen ihrer jeweiligen Energien, die es ermöglichen, die Energielücken zu beobachten, die sie trennen. Vor allem erklärt der Paramagnetismus bestimmter Substanzen, wie z. B. molekularer Sauerstoff im flüssigen Zustand (siehe oben).
Das Ö2, Beschrieben von Lewis 'Strukturen und der Link -Theorie von Valencia, es hat alle seine gepaarten Elektronen, so dass es theoretisch diamagnetisch sein sollte. In der Praxis wurde jedoch gezeigt, dass es tatsächlich paramagnetisch ist, das heißt, es gibt fehlende Elektronen; Speziell ein Paar fehlender Elektronen.
Aus der Konstruktion des OM -Diagramms (molekulare Orbitale) für das o2, Ein homonukleäres Diatommolekül, es ist ersichtlich, dass es zwei fehlende Elektronen mit hoher Energie geben wird. Nicht nur das, sondern auch der Spin und die Position dieser Elektronen in der OMS erklären auch andere elektronische Zustände des OR2 (einzel).
Andere der wichtigsten Triumphe der molekularen Orbitalentheorie sind, dass sie die mögliche Existenz von zweistufigen Molekülen sowie deren relative Stabilität vorhersagt. Somit ist die molekulare Orbitalentheorie in der Vorhersage von Molekülen wie b richtig2 und li2, Auch wenn sie nur in der Dampfphase bei hohen Temperaturen erkennen können. Auch diese Theorie lehnt die Existenz des hypothetischen, den ich habe2 oder ne2.
Arten von molekularen Bindungen und Orbitalen
Wie bei der Valencia -Link -Theorie werden in der molekularen Orbitalentheorie in Abhängigkeit von der Richtlinie der Überlappung von Atomorbitalen in Abhängigkeit von der chemischen Bindung verschiedene Arten von Verbindungen berücksichtigt. Unter den wichtigsten und gegenwärtigsten in molekularer Natur haben wir die Sigma- und PI -Bindungen.
Sigma
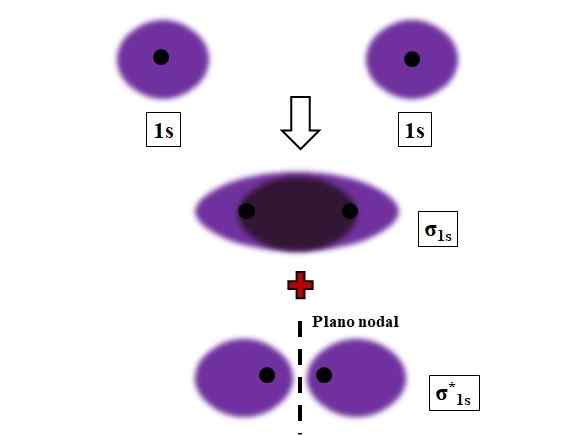 Bildung von σ1s und σ1s* -Blinks während der Überlappung von zwei Atomorbitalen 1s. Quelle: Gabriel Bolívar.
Bildung von σ1s und σ1s* -Blinks während der Überlappung von zwei Atomorbitalen 1s. Quelle: Gabriel Bolívar. Sigma, σ -Bindungen werden festgelegt, wenn sich Atomorbitale in Bezug auf eine imaginäre internukleäre Axe frontal überlappen.
Betrachten Sie beispielsweise die σ -Verbindung, die gebildet wird, wenn zwei 1S -Atomorbitale gemäß einem Wasserstoffatom nahezu kurz sind (Bild oben), nahe an einem sehr kurzen Abstand. Da 1S -Orbitale symmetrisch sind, ist ihre Überlappung immer frontal; Daher erzeugen sie immer molekulare Orbitale σ1s und σ1s*.
Beachten Sie jetzt, dass molekulares Orbital σ1s zeigt eine elektronische Dichte, die im Raum konzentriert ist, der die beiden Kerne trennt. Dies bedeutet, dass in einem Orbital σ1s Die Wahrscheinlichkeit, ein Elektron in diesem Bereich des Moleküls zu finden, ist maximal. Die Elektronen von σ1s Sie werden durch den Raum verlegt, der die lila Farbe abdeckt.
Andererseits im Orbital σ1s* Wir haben eine Knotenebene zwischen den beiden Kernen. Dies bedeutet, dass die Wahrscheinlichkeit, ein Elektron zwischen diesem Raum zu finden, gleich Null ist. Beachten Sie das im Orbital σ1s* Elektronen beschreiben Positionen um jeden der beiden Kerne; Nicht um das Molekül als Ganzes.
Kann Ihnen dienen: Radio: Struktur, Eigenschaften, Verwendungen, ErhaltenPi
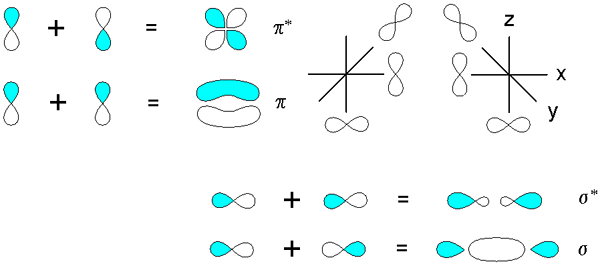 Sigma- und PI -Bindungen, die aus der Überlappung der Orbitale abgeleitet sind P. Quelle: v8rik bei IN IN.Wikipedia, CC BY-SA 3.0, über Wikimedia Commons
Sigma- und PI -Bindungen, die aus der Überlappung der Orbitale abgeleitet sind P. Quelle: v8rik bei IN IN.Wikipedia, CC BY-SA 3.0, über Wikimedia Commons Betrachten Sie nun die molekularen Bindungen und Orbitale. Diese treten auf, wenn die Überlappung der Orbitale in eine Richtung senkrecht zur internuklearen Achse auftritt, die willkürlich in einer der Achsen der kartesischen Ebene festgelegt ist. Angenommen, wir sprechen über ein 2p -OrbitalX, Das 2p -OrbitalUnd Es ist frei, einen PI -Link aufzubauen (siehe blaue und weiße Lappen).
Wenn zwei Orbitale 2pUnd Zwei molekulare Orbitale entstehen: π2py und π2py*; Der erste hat die höchste elektronische Dichte und unterhalb der internuklearen Achse, während der zweite einer vier -petalen Blume ähnelt, wobei die Wahrscheinlichkeit, Elektronen zu finden.
Andererseits die Orbitale 2p, um 2p zu sagenX, Sie können sich auch frontal überlappen, um eine σ -Bindung und zwei molekulare Orbitale σ zu stammen2px und σ2px*. Wie in den Fällen von σ1s und σ1s*Das Orbital σ2px zeigt eine größere elektronische Dichte zwischen den beiden Kernen; das widerspricht σ2px*, wo Elektronen auf den Seiten von außen ausgerichtet sind.
Verknüpfung
Lindende molekulare Orbitale sind diejenigen, die zur Stabilität des Moleküls beitragen. Das heißt, sie müssen weniger Energie im Vergleich zu den Atomorbitalen einzelner Atome haben, bevor sie das Molekül verknüpfen und bilden. In diesen Orbitalen werden die Elektronen durch alle Abmessungen des Moleküls als Ganzes verlegt.
In den OM -Diagrammen befinden sich diese immer unter den atomaren Orbitalen, die sich kombinierten, um sie zu bilden. Dies wird in den nächsten Abschnitten ausführlicher angezeigt.
Anti -Hut
Die Anti -Housing -molekularen Orbitale hingegen sind diejenigen, die das Molekül destabilisieren. Sie werden mit einem Sternchen (*) symbolisiert, und ihre Energien sind höher als die der atomaren Orbitale, die sie stammen. In diesen Orbitalen werden die Elektronen ziemlich unregelmäßig verlegt, als wäre das Molekül elektronisch fragmentiert.
In OM -Diagrammen befinden sie sich immer über den atomaren Orbitalen, die sich kombinierten, um sie zu bilden.
Nicht verbunden
In der Zwischenzeit sind nicht linkende Orbitale sowie deren Elektronen diejenigen, die die Stabilität des Moleküls nicht beitragen oder schädigen. Seine Energien sind denen von Atomorbitalen sehr ähnlich.
Verknüpfungsreihenfolge
Die Verbindungsreihenfolge wird in der Theorie des molekularen Orbital. Somit entspricht eine Verknüpfungsreihenfolge von 1 einem einfachen Link (-). Und eine Linkauftrag (oder.e) gleich 2 entspricht einer Doppelbindung (=). Bald.
Diese Reihenfolge wird aus der Zählung von Elektronen in den OM -Diagrammen für ein bestimmtes Molekül ermittelt. Dazu muss die folgende Formel angewendet werden:
entweder.E = (Anzahl der verknüpften Elektronen - Anzahl der Anti -Hut -Elektronen)/2)
Verbindungselektronen tragen zum Stabilisieren des Moleküls bei, während antifierige Elektronen es destabilisieren. Daher desto mehr anti -sunger Elektronen, desto kleiner das oder desto kleiner.E und das Molekül neigt dazu, sehr instabil zu sein. Wenn der o.E ist gleich 0, es bedeutet, dass das Molekül nicht existiert (oder zumindest theoretisch).
OM -Diagramme
In den OM -Diagrammen werden die Energien der molekularen Orbitale dargestellt, und ihre elektronische Füllung wird ebenfalls sichtbar gemacht, was den Regeln von Aufbauf und Sinn sowie das Prinzip des Ausschlusses von Pauling befolgt. Betrachten Sie beispielsweise die folgenden zwei Diagramme:
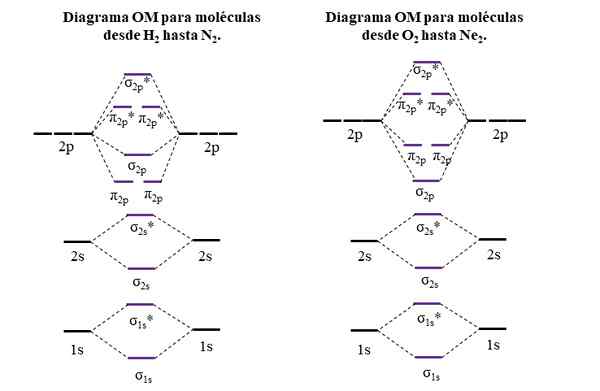 OM -Diagramme für Moleküle der ersten und zweiten Periode der Periodenzüchter. Quelle: Gabriel Bolívar.
OM -Diagramme für Moleküle der ersten und zweiten Periode der Periodenzüchter. Quelle: Gabriel Bolívar. Horizontale Linien an den Seiten, schwarz, repräsentieren die Energien von Atomorbitalen. Stattdessen sind zentrale horizontale Linien lila die Energien der molekularen Orbitale. Beachten Sie, wie die Verknüpfung und die Anti -Agent -OMS in Bezug auf die Atomorbitale einzelner Atome verteilt sind (*).
Es kann Ihnen dienen: eine Amino -Gruppe (NH2): Struktur, Eigenschaften, BeispieleBeachten Sie auch, dass im richtigen Diagramm das OM σ2 p Sie ändern den Platz mit π2 p. Dies geschieht bei den Molekülen von o2, F2, und der hypothetische ne2.
Beispiele
In den folgenden Beispielen wird das OM mit den Elektronen fortgesetzt, die Verbindungsreihenfolge berechnen und Vorhersagen über die Kraft der Bindung oder Stabilität des betreffenden Moleküls treffen.
H2
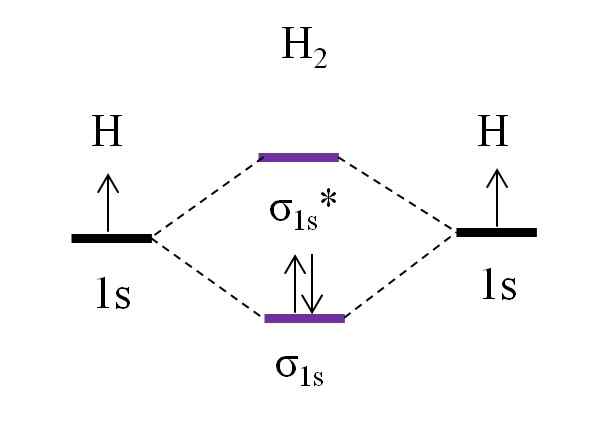 OM -Diagramm für Dihydrogenmolekül. Quelle: Gabriel Bolívar.
OM -Diagramm für Dihydrogenmolekül. Quelle: Gabriel Bolívar. Beginnend mit dem einfachsten Molekül, dem von Dihydrogen, h2, Zwei H -Atome werden durch Kombination ihrer beiden 1S -Atomorbitale mit zwei molekularen Orbitalen σ verknüpft1s und σ1s*. Die beiden Elektronen füllen dann die molekularen Orbitale aus.
Zuerst wird das Orbital σ gefüllt1s, Weil es die geringste Energie ist (Aufbauf -Regel). Dann muss das zweite Elektron das Orbital σ fertigstellen1s Vor dem Klettern auf das Orbital σ1s* (Senkregel). Und schließlich führt dieser zweite Elektron seinen Spin in die entgegengesetzte Richtung zum ersten Elektron (Pauling -Ausschlussprinzip). Somit befinden sich die beiden Elektronen im verknüpften Orbital σ1s.
Was ist mit der Link -Bestellung?? Im Link Molekular Orbital σ1s Wir haben 2 Elektronen; Während im anti -hellhelligen molekularen Orbital σ1s* wir haben keine. Daher wäre die Berechnung:
entweder.E = (2-0)/2
= 1
Sein oder.Und gleich 1 bedeutet dies, dass die Verbindung, die die beiden Wasserstoffatome verbindet, einfach ist: H-H. Wenn dieser Wert gleich oder größer als 1 ist, wird im Allgemeinen gesagt, dass das Molekül existiert und stabil ist.
Er2
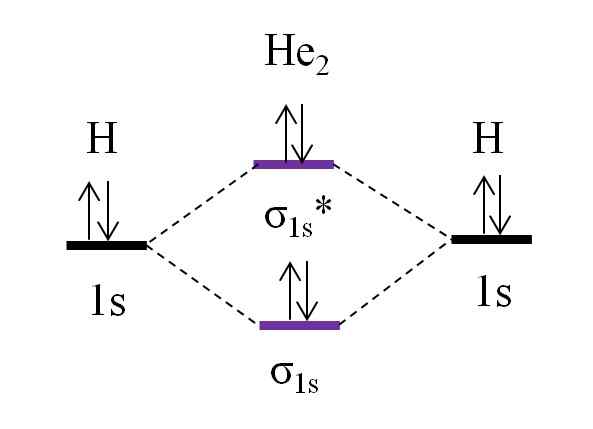 OM -Diagramm für hypothetisches Dihelio -Molekül. Quelle: Gabriel Bolívar.
OM -Diagramm für hypothetisches Dihelio -Molekül. Quelle: Gabriel Bolívar. Nehmen wir an, Sie haben das Molekül von ihm2. Oben sehen wir, dass sein OM -Diagramm dem H sehr ähnlich ist2, Mit 2 zusätzlichen Elektronen, die sich im Orbital σ befinden1s*. Wenn insgesamt 4 Elektronen die beiden Atome hinzufügen, müssen auch 4 Elektronen in allen resultierenden molekularen Orbitalen vorhanden sein.
Bestimmen des o.E für das i er2 wir werden haben:
entweder.E = (2-2)/2
= 0
Dies bedeutet, dass es keine mögliche Verbindung gibt, die die beiden Heliumatome. In der Tat wurde bisher die Existenz dieses Moleküls nicht identifiziert, was mit den Vorhersagen der molekularen Orbitalentheorie übereinstimmt.
B2
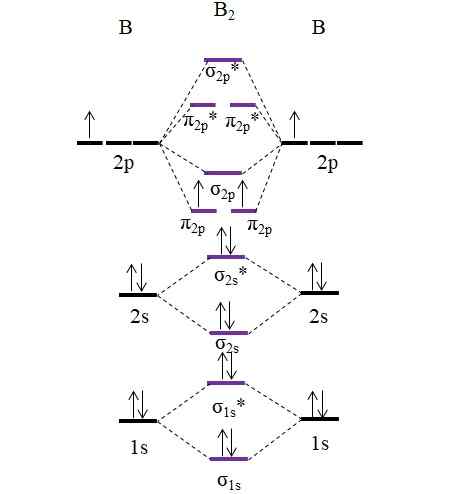 OM -Diagramm für das B2 -Molekül. Quelle: Gabriel Bolívar.
OM -Diagramm für das B2 -Molekül. Quelle: Gabriel Bolívar. Beachten Sie, dass bei der Bildung molekularer Orbitale auch die Elektronen der internen Schichten berücksichtigt werden; Nicht nur die von Valencia.
Somit im Beispiel des Diboro -Moleküls b2, Jedes Boratom trägt insgesamt 5 Elektronen bei, von denen 3 von Valencia stammen; Dies sind diejenigen ihrer 2S- und 2p -Orbitale. Die beiden Elektronen der Orbitale 2p sind in verschiedenen molekularen Orbitalen π positioniert2 p Mit parallelen Stacheln (Sink -Regel).
Anschließend berechnen wir die Verbindungsreihenfolge:
entweder.E = (6-4)/2
= 1
Daher wird erwartet, dass das Molekül eine einfache B-B-Verbindung hat. Das B2 Es ist ein Molekül, das bei sehr hohen Temperaturen nur in der Dampfstufe vorhanden ist, da Bor unter normalen Bedingungen komplexere Netzwerkstrukturen und -designs anwendet.
C2 und C22-
Betrachten Sie zuerst das OM -Diagramm für Molekül C2:
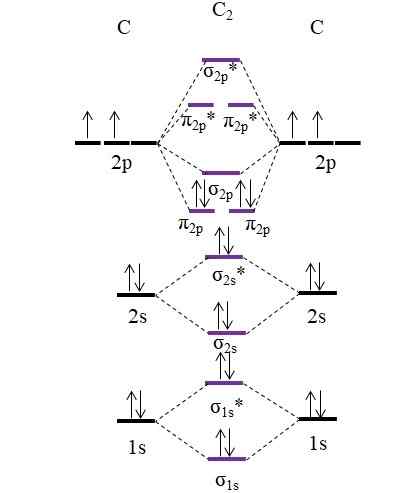 OM -Diagramm für Molekül C2. Quelle: Gabriel Bolívar.
OM -Diagramm für Molekül C2. Quelle: Gabriel Bolívar. Jetzt sind die beiden neuen Elektronen, die durch Kohlenstoffatome bereitgestellt werden, wieder in den molekularen Orbitalen π positioniert2 p Aber mit entgegengesetzten Spins (Pauling -Ausschlussprinzip).
Ermitteln Sie Ihre Link -Bestellung, die wir haben werden:
entweder.E = (8-4)/2
= 2
Beachten Sie, dass molekulare Orbitale π2 p Fügen Sie 4 Elektronenbindungen zur Formel hinzu. Da diese Reihenfolge gleich 2 ist, bedeutet dies, dass Molekül c2 Es hat eine Doppelbindung, c = c. Wieder Molekül C2, Auch Diatomkohlenstoff bezeichnet, gibt es nur Dampfphase bei hohen Temperaturen und ist eine der einfachsten allopischen Formen von Kohlenstoff.
Und was ist mit C22-? Ihr OM -Diagramm lautet wie folgt:
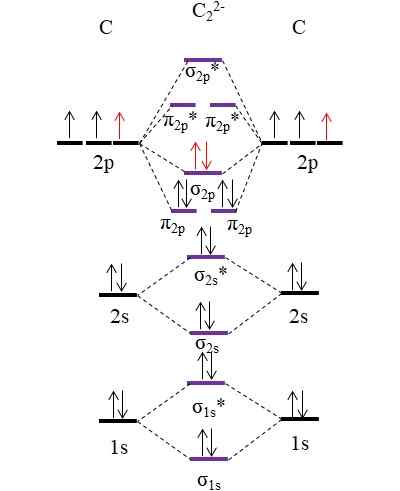 OM -Diagramm für Anion C22-. Quelle: Gabriel Bolívar.
OM -Diagramm für Anion C22-. Quelle: Gabriel Bolívar. Die beiden neuen Elektronen (rote Pfeile) sind im Verknüpfungsmolekülorbital σ positioniert2 p. Dies setzt somit an, dass jedes Kohlenstoffatom eine der beiden negativen Ladungen beiträgt (für einen Oxidationszustand von -1).
Kann Ihnen dienen: Quecksilberfulminat: Struktur, Eigenschaften, erhalten, verwendet, verwendetBerechnen Sie Ihre Link -Reihenfolge, die wir haben werden:
entweder.E = (10-4)/2
= 3
Das heißt, Anion c22-, Auch als Anion Acetyluro bezeichnet, hat es eine dreifache Verbindung, [C≡C]2-. Es ist ein relativ stabiles Anion mit einer großen Verbindungskraft; Abhängig von seinen Gegenstückionen kann es jedoch explosive Verbindungen entstehen.
N2 und n2+
Das berühmte Stickstoffmolekül, n2, Es kann auch perfekt unter Verwendung molekularer Orbitaldiagramme beschrieben werden:
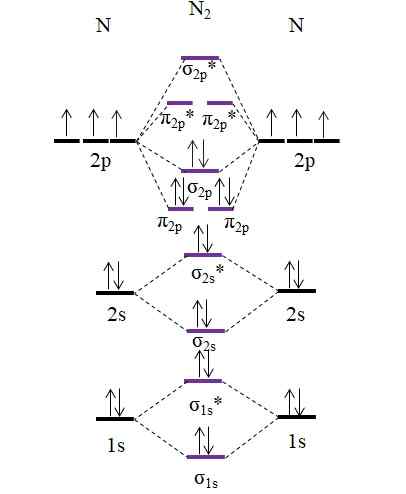 OM -Diagramm für das N2 -Molekül. Quelle: Gabriel Bolívar.
OM -Diagramm für das N2 -Molekül. Quelle: Gabriel Bolívar. Beachten Sie, dass dieses Diagramm genau das gleiche ist wie bei Anion C22-. Das bedeutet, dass n2 und C22- Sie sind isolektronisch. Eine solche Tatsache bedeutet jedoch nicht, dass beide Arten auf die gleiche Weise verhalten. Dann2, Neutral, ist viel stabiler als C22-, negativ, auch wenn beide eine Verbindungsreihenfolge gleich 3, Nais.
Und was ist mit Kation n2+? Schauen wir uns Ihr OM -Diagramm an:
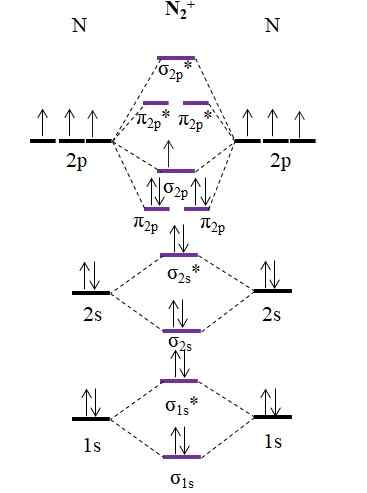 OM -Diagramm für Kation N2+. Quelle: Gabriel Bolívar.
OM -Diagramm für Kation N2+. Quelle: Gabriel Bolívar. Wie Kation n2+ Es hat ein Elektron weniger, dies wird das molekulare Orbital σ entfernt2 p. Dann2 Es ist diamagnetisch, während der n2+ Es ist paramagnetisch. Und seine Link -Bestellung lautet:
entweder.E = (9-4)/2
= 2.5
Ein 2 2 Link.5 würde mit zwei Zeilen und einem Punkt dargestellt werden. So etwas macht in Valencias Theorie oder in Lewis 'Strukturen jedoch nicht viel Sinn. Da diese Link -Reihenfolge weniger als 3 beträgt, ist die Kraft des in der n vorhandenen Verbindung2+ ist niedriger als der n2, Es ist also instabiler.
ENTWEDER2, ENTWEDER22- ICH22+
Lassen Sie uns nun ein anderes sehr wichtiges Molekül für das Leben sehen: molekularer oder diatomischer Sauerstoff, oder2. Nach Valencias Theorie und Lewis 'Strukturen sollte es diamagnetisch sein. Experimentell wurde jedoch gezeigt, dass es paramagnetisch ist, so dass es irgendwo Elektronen verschwunden ist.
Unten vergleichen wir die OM -Diagramme für das o2 und Ionen oder22- (Oxid) und o22+ (Oxidation):
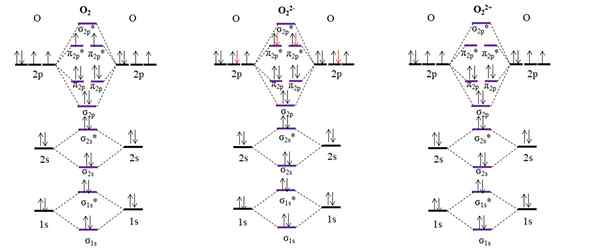 OM -Diagramme für molekulare Sauerstoff und zwei seiner Hauptionen. Quelle: Gabriel Bolívar.
OM -Diagramme für molekulare Sauerstoff und zwei seiner Hauptionen. Quelle: Gabriel Bolívar. Das OM -Diagramm für das o2 Probe im Gegensatz zu den vorherigen, dass die molekularen Orbitale σ2 p und π2 p ihre Energieposition ändern. Wir sehen auch effektiv, dass es in den Orbitalen π zwei fehlende Elektronen gibt2 p*, was das paramagnetische Charakter von Sauerstoff erklärt (zu Beginn des Artikels erwähnt).
Andererseits haben wir auch das OM -Diagramm für Anion oder22-, In den Kosmos unendlich verbreitet (Monde, Planeten, Kometen, Asteroiden usw.). Es hat zwei zusätzliche Elektronen (rote Pfeile), die die π -Orbitale beenden,2 p*, alle Elektronen kombinieren. Folglich die oder22- Es ist diamagnetisch.
Wir betrachten auch das OM -Diagramm zur Oxidation oder22+. Es hat zwei Elektronen weniger als das o2, Leeren Sie die Orbitale π leer lassen2 p*. Alle seine Elektronen werden gepaart und daher diamagnetisch.
Linkbestellungen für das o2, ENTWEDER22- ICH22+ Sie sind jeweils: 2 (o = o), 1 [o-o]2- und 3 [O≡O]2+. Daher das o22+ hätte den stärksten Link.
Vorteile und Nachteile
Vorteile
Unter den Vorteilen der molekularen Orbitalentheorie können wir Folgendes zitieren:
-Es ermöglicht die Bewertung von Verbindungsaufträgen, die gewöhnlich in der Valencia -Link -Theorie nicht viel Sinn machen würde
-Es korreliert gut mit Diamagnetismus und Paramagnetismus von Molekülen
-Der Abstand, der molekulare Orbitale in den Diagrammen trennt
-Gilt nicht nur für homonukleäre zweikernige Diatommoleküle, sondern auch für heteronukleäre Moleküle wie CO2 und Benzol
-Es erweitert sein Modell auf andere Arten von Verbindungen, wie z. B. anorganische Komplexe, so dass es die Theorie des Gebiets der Liganden unterstützt
-Die Überlegung, dass Elektronen im gesamten Molekül verlagert werden
Nachteile
Und unter einigen der Nachteile der molekularen Orbitalentheorie, die wir haben, um zu enden:
-Es ist sehr abstrakt und erfordert ein tiefes mathematisches Verständnis, um es vollständig zu verstehen
-Molekulationsdiagramme als co2, Co, h2Oder und andere können sie zu mühsam sein, um auszuarbeiten und zu erklären
-Er sagt nichts über bestimmte Regionen oder Verbindungen eines großen Moleküls aus
-Es liefert auch keine Informationen zur molekularen Geometrie (trigonale Ebene, Quadratebene, Tetraedrale usw.).
-Es ist nicht so grafisch wie Valencias Verbindungstheorie
Die molekulare Orbitalentheorie ist abschließend eine Theorie, die die Theorie der Valencia -Verbindung ergänzt, um ein breiteres und vollständigeres Panorama des Molekularspektrums zu haben.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2020). Orbitalmolekulartheorie. Abgerufen von: in.Wikipedia.Org
- Stephen Lower. (7. September 2020). Orbitalmolekulartheorie. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Steven a. Hardinger. (2017). Orbitalmolekulartheorie. Abgerufen von: Chemed.Chem.Purdue.Edu
- Pressebücher. (S.F.). Kapitel 8: Orbital -Molekulartheorie. Abgerufen von: opentextbc.AC

