Säure-Basen Arrhenius, Bronsted-Lowry-Theorien, Lewis

- 1711
- 27
- Rieke Scheer
 Grafik, das die drei Haupttheorien von Säuren und Basen bezieht. Quelle: TEM5PSU, CC BY-SA 3.0, über Wikimedia Commons
Grafik, das die drei Haupttheorien von Säuren und Basen bezieht. Quelle: TEM5PSU, CC BY-SA 3.0, über Wikimedia Commons Was sind Säure- und Basistheorien?
Säure- und Basistheorien sind eine Reihe konzeptioneller Beiträge, die Säuren und Basen definieren und differenzieren, zwei Konglomerate von immensen Relevanzsubstanzen in den Feldern der Chemie.
Seine Wurzeln stammen aus den ersten Charakterisierungen von Robert Boyle im Jahr 1661, der Säuren wie saure und ätzende Substanzen definierte, die die Farbe des blauen zu roten Frühlingspapiers verändern. Und die Basen wie Soapy -Substanzen, die im Gegensatz zu Säuren die Farbe des roten bis blauen Schienbeinpapiers verändern.
Antoine Lavoizier schlug vor, dass alle Säuren Sauerstoffatome wie H enthalten2SW4 und hno3. Jahrhunderte später im Jahr 1811 stellte Humphry Davy fest, dass viele Säuren tatsächlich keine Sauerstoffatome wie HCl, HF, HBR usw. besitzen.
Und kurz vor dem Auftreten der berühmten Säure-Base-Triade (überlegenes Bild) schlug Justig Liebig vor, dass Säuren Wasserstoffatome aufweisen können, die durch Metallkationen ersetzt werden können.
Dieses empirische Wissen diente als Inspiration für die aktuellen Theorien von Säuren und Basen: Arrhenius, Bronsted-Lowry und Lewis. Wie in der Grafik zu sehen ist, ist Arrhenius 'Theorie die restriktivste oder begrenzte von allen, während Lewis der allgemeinste und globalisierte ist.
Arrhenius -Theorie
Vorgeschlagen von Svante Arrhenius von 1884, sagt seine Theorie, dass Säuren beim Auflösen in Wasser Ionen erzeugen H3ENTWEDER+ oder h+; Während die Basen beim Auflösen in Wasser OH -Ionen produzieren oder freisetzen-.
Die Ionen h3ENTWEDER+ und oh- Sie kombinieren in einer reversiblen Reaktion, die Wassermoleküle hervorruft:
H3ENTWEDER+ + Oh- ⇌ 2H2ENTWEDER
Kann Ihnen dienen: Disulfursäure: Was ist, Struktur, Eigenschaften, verwendetEine Arrhenius -Säure ist also auch diejenige, die die Konzentration von H -Ionen erhöht3ENTWEDER+, Während eine Arrhenius -Basis eine ist, die die Ionenkonzentration OH erhöht-.
Dies bedeutet, dass eine Arrhenius -Säure nicht unbedingt Hionen enthalten sollte3ENTWEDER+, Und eine Arrhenius -Basis muss keine OH -Ionen haben- In seiner Struktur.
Beispiel und Einschränkungen
Betrachten Sie die folgenden Dissoziationen:
HCl (AC) → H+(Ac) +cl-(Ac)
NaOH (AC) → Na+(Ac) +oh-(Ac)
HCL ist eine Arrhenius -Säure, denn wenn sie in Wasser gelöst ist, erzeugt es H -Ionen+, oder genauer gesagt, h Ionen3ENTWEDER+. Und andererseits ist Naoh eine Arrhenius -Basis, denn wenn es in Wasser gelöst ist, freisetzt sich OH -Ionen-. Diese Substanzen reagieren aufeinander, um Salz und Wasser zu erzeugen:
HCl (AC) + NaOH (AC) → NaCl (AC) + H2ENTWEDER
Das Problem mit der Arrhenius -Theorie liegt in der Tatsache, dass es nur auf wässrige Lösungen beschränkt ist und daher nur für Substanzen gilt, die in Wasser löslich sind. Zum Beispiel ist das MGO im Wasser sehr unlöslich und dennoch ein Basisoxid.
Es ist auch nicht in der Lage, selbst zu erklären, wie Substanzen wie NH3 und Cao produzieren OH -Ionen- in Wasser aufgelöst, auch wenn sie keine Ionen haben oh- In seiner molekularen oder kristallinen Struktur (wie bei NaOH oder KOH).
Und er erklärt nicht, wie der CO2 Kann Ionen h freigeben H3ENTWEDER+ In Wasser ohne Wasserstoffatom in seiner molekularen Struktur (wie bei HCl oder H der Fall2SW4).
Brönsted-Lowry-Theorie
Vorschlag einzeln im Jahr 1923 von Johannes Bronsted und Thomas Lewry, ihre Theorie von Säuren und Basen besagt, dass eine Säure all diese Substanz ist, die Ionen spenden kann+, und dass eine Basis stattdessen eine Substanz ist, die diese h akzeptieren kann+. Diese Theorie ist allgemeiner als die von Arrhenius und deckt einige ihrer Grenzen ab.
Kann Ihnen dienen: Molare Lösungen: Konzept, Vorbereitung, BeispieleBeispiel
Betrachten Sie die Neutralisationsgleichung zwischen H erneut3ENTWEDER+ Und ein OH- Zwei Wassermoleküle produzieren:
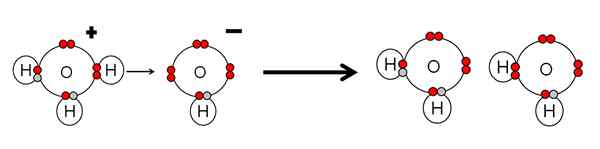 Beispiel für die Säure -Neutralisierung und Wasserbasis. Quelle: Gabriel Bolívar.
Beispiel für die Säure -Neutralisierung und Wasserbasis. Quelle: Gabriel Bolívar. Beachten Sie, dass h3ENTWEDER+ A h+ was sofort mit dem OH verknüpft oder koordiniert wird- richtig richtig. Wenn H+ Es endet mit einem der elektronenfreien Paare der OH-, Zwei neutrale Wassermoleküle bleiben als Produkte bestehen.
Die h3ENTWEDER+ Daher handelt es sich um eine BRNsted-Lowry-Säure, um das H zu spenden+, Und der OH- Es ist eine Basis von BRNsted-Lowry, um dies zu akzeptieren+.
Ein weiteres Beispiel für eine Säure-Base-Reaktion ist wie folgt:
NH3(g) + hcl (g) → nh4Cl (s)
Diese Reaktion konnte laut Arrhenius nicht als Säure-Base-Typ angesehen werden. Der NH3 Es ist eine Basis von BRNsted, weil es die HCl H akzeptiert, indem ein paar Elektronen am Stickstoffatom gespendet werden. Und die logische HCL wird zur Brnsted -Säure.
Somit ist das MGO eine Basis mit BRNsted, weil es h akzeptieren kann+ von Säuren, um sich in MG zu verwandeln (OH)2.
Lewis -Theorie
Die Theorie von Bronsted-Lowry erklärt ein breites Spektrum von Säure-Base-Reaktionen. Ignorieren Sie jedoch diese Reaktionen, bei denen Hionen+ und oh- Sie sind überhaupt nicht involviert sowie eine stärkere Beteiligung freier Elektronen an molekularen Mechanismen.
So 1923 g. N. Lewis schlug eine Säure-Base-Theorie vor, in der lautst: eine Säure ist jede Substanz, die in der Lage ist, Paare von Elektronen zu akzeptieren, während eine Base eine ist, die diese Elektronenpaare spendet.
Es kann Ihnen dienen: DAPI (4 ', 6-Diamidino-2-fenylindol): Eigenschaften, Grundlage, VerwendungZum Beispiel Ion H+ Es ist eine Lewis -Säure, weil sie Elektronenpaare von Arten in der Nähe akzeptiert: von h2Oder HIR HERSTELLEN H3ENTWEDER+, von NH3 NH zu studieren4+, usw.
Beispiel und Vorteile
Betrachten Sie ein anderes Beispiel in der folgenden Reaktion:
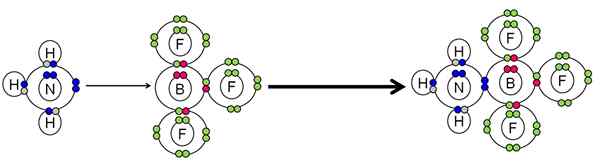 Beispiel für die Neutralisation zwischen einer Säure und einer Lewis -Base. Quelle: Gabriel Bolívar.
Beispiel für die Neutralisation zwischen einer Säure und einer Lewis -Base. Quelle: Gabriel Bolívar. Der NH3 Ein Paar Elektronen (blau) des Stickstoffatoms zum BF Bor -Atom erledigt3. Daher das NH3 Es ist die Basis von Lewis, weil es das Elektronenpaar spendet, und das BF3 Es ist Lewis 'Säure, weil er sie akzeptiert.
Im Allgemeinen sind Kationen und schlechte Elektronenspezies Lewis -Säuren, während Anionen und Elektronenspezies Lewis -Basen sind.
Die angebotenen Vorteile.
Zum Beispiel: h2O Es hat freie Elektronen im Sauerstoff. Wenn Sie einen von ihnen für ein Ion h spenden+, wird als Lewis -Basis fungieren, der h ist+ Folglich Lewis -Säure.
Laut Bronsted-Lowry, h2Oder ich würde als Basis fungieren+ Durch Spenden einiger ihrer kostenlosen Elektronen. Und schließlich h2Oder es ist auch eine Basis nach Arrhenius 'Theorie, weil die Konzentration von H -Ionen abnimmt+ in der wässrigen Umgebung und folglich die Konzentration von OH -Ionen erhöht-.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Clark Jim. (2002). Theorien von Säuren und Basen. Erholt von: Chemguide.CO.Vereinigtes Königreich
- Broderick c., Moussa m., & Clark J. (21. August 2020). Überblick über Säuren und Basen. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Wikipedia. (2020). Säure-Base-Reaktion. Abgerufen von: in.Wikipedia.Org
- Texas A & M Universität. (S.F.). Säuren und Basen: Entwicklung von Säuren und Basen. Erholt von: Chem.Tamu.Edu

