Dritter Gesetz der Thermodynamikformeln, Gleichungen, Beispiele
- 2782
- 7
- Ivan Pressler
Der Dritter Gesetz der Thermodynamik Gibt an, dass die Entropie eines geschlossenen thermodynamischen Systems im Gleichgewicht tendenziell minimal und konstant ist, da seine Temperatur 0 Kelvin nähert.
Dieser Wert der Entropie ist unabhängig von den Systemvariablen (unter anderem der Druck oder das angelegte Magnetfeld). Was passiert, ist, dass die Temperatur mit 0 K näher an 0 K ist, die Prozesse im System gestoppt werden und wie Entropie ein Maß für die innere Bewegung ist, steigt sie notwendigerweise ab.
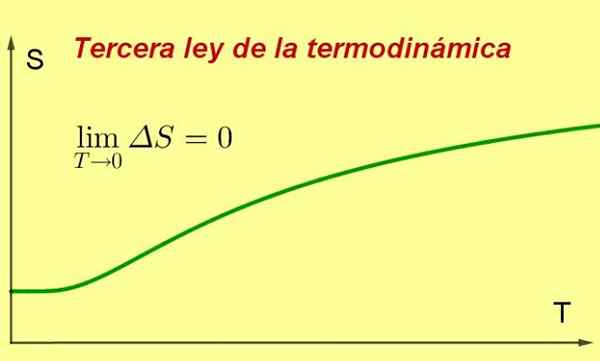
 Abbildung 1. Wenn sich die Temperatur eines Systems der absoluten Null nähert, erreicht seine Entropie einen minimalen und konstanten Wert. Quelle: Vorbereitet von f. Zapata ..
Abbildung 1. Wenn sich die Temperatur eines Systems der absoluten Null nähert, erreicht seine Entropie einen minimalen und konstanten Wert. Quelle: Vorbereitet von f. Zapata .. [TOC]
Frühere Konzepte
Um den Umfang des dritten Gesetzes der Thermodynamik zu verstehen, die für sehr niedrige Temperaturen relevant sind, müssen die folgenden Konzepte überprüft werden:
Thermodynamisches System
Es bezieht sich normalerweise auf ein Gas, eine Flüssigkeit oder einen Feststoff. Was nicht Teil des Systems ist, heißt um. Das häufigste thermodynamische System ist das ideale Gas, das aus N -Partikeln (Atomen) besteht, die nur durch elastische Kollisionen interagieren.
Isolierte, geschlossene oder offene Systeme
Isolierte Systeme dürfen keinen Austausch mit der Umgebung haben. Geschlossene Systeme tauschen Materie nicht mit der Umwelt aus, sondern Wärme. Schließlich können offene Systeme sowohl Materie als auch Wärme mit der Umgebung austauschen.
Makrostaat und Mikrostata
Das Makrostaat eines Systems ist der Satz von Werten, die seine Variablen haben: Druck, Temperatur, Volumen, Anzahl der Maulwürfe, Entropie und interne Energie. Andererseits ist das Mikro -Beachtungsgefühl im Fall eines idealen Gases, der durch die Position und den Impuls jedes der N -Partikel angegeben ist, die es in einem bestimmten Moment ausmachen.
Viele Mikrostatten können zu demselben Makrostaat führen. In einem Gas bei Raumtemperatur ist die Anzahl der möglichen Mikrostata immens, da die Anzahl der Partikel, die es ausmachen, die verschiedenen Positionen und die verschiedenen Energien, die sie annehmen können.
Formeln und Gleichungen
Entropie, wie wir sagten, ist eine thermodynamische makroskopische Variable, die das System der molekularen Störung des Systems misst. Der Grad der Störung eines Systems ist in dem Maße größer, als die Anzahl der möglichen Mikrostatten größer ist.
Dieses Konzept ist erforderlich, um das dritte Gesetz der Thermodynamik in mathematischer Form zu formulieren. Sei es die Entropie des Systems, dann:

Entropie ist eine makroskopische Zustandsvariable, die mithilfe der folgenden Formel direkt mit der Anzahl der möglichen Mikrostata eines Systems zusammenhängt:
S = k ln (w)
In der vorherigen Gleichung: S Repräsentiert Entropie, W die Anzahl der möglichen Mikrostaten des Systems und k Es ist Boltzmanns Konstante (K = 1.38 x 10-23 J/k). Das heißt, die Entropie eines Systems ist k mal den natürlichen Logarithmus der Anzahl möglicher Mikrostates.
Berechnung der absoluten Entropie einer Substanz
Es ist möglich, die absolute Entropie einer reinen Substanz auf der Grundlage der Definition der Variation der Entropie zu definieren:

ΔQ = n . CP .Dt
Hier ist CP die spezifische Molarenwärme und n der Anzahl der Maulwürfe. Die molarspezifische Wärmeabhängigkeit mit der Temperatur ist eine experimentell erhaltene Tatsache und für viele reine Substanzen bekannt.
Kann Ihnen dienen: Sonnensystem: Planeten, Eigenschaften, Herkunft, EvolutionNach dem dritten Gesetz in reinen Substanzen:
=0)
=\int_0^T\frac\overlinec_pdTT)
Anwendungen
Im täglichen Leben hat das dritte Gesetz der Thermodynamik nur wenige Anwendungen, was dem ersten und zweiten Gesetz entspricht. Es liegt daran.
Tatsächlich ist das Erreichen des Absoluten oder –273,15 ° C unmöglich (siehe Beispiel 1 später). Das dritte Gesetz wird jedoch bei der Untersuchung der Reaktion der Materialien bei sehr niedrigen Temperaturen angewendet.
Dank dessen sind wichtige Fortschritte in der Kondensatualisierung entstanden, wie beispielsweise:
-Superfluidität (siehe Beispiel 2 später)
-Supraleitigkeit
-Laserkühlungstechniken
-Bose-Einstein-Kondensat
-Fermi überflüssige Gase.
 Figur 2. Überflüssiger flüssiges Helium. Quelle: Wikimedia Commons.
Figur 2. Überflüssiger flüssiges Helium. Quelle: Wikimedia Commons. Bei extrem niedrigen Temperaturen ermöglicht der Abstieg der Entropie die Entstehung interessanter Quantenphänomene. Lassen Sie uns daher sehen, was mit der Entropie eines sehr niedrigen Temperatursystems passiert.
Entropie eines Tieftemperatursystems
Wenn Sie eine perfekte kristalline Substanz haben, ist die minimale Entropie genau Null, da es sich um eine sehr ordentliche Art handelt. Bei Temperaturen in der Nähe von Absolut 0 befindet sich die Materie im Kondensatus (flüssig oder fest) und Glasvibrationen sind minimal.
Einige Autoren betrachten eine alternative Aussage des dritten Thermodynamik -Gesetzes Folgendes:
"Wenn Materie ein perfekter Kristall bildet, wenn die Temperatur zu absolutes Null tendiert, nimmt die Entropie genau auf Null.".
Lassen Sie uns einige Aspekte der vorherigen Aussage püngen:
- Ein perfekter Kristall ist einer, bei dem jedes Molekül identisch ist und in der die molekulare Struktur identisch in seiner Gesamtheit wiederholt wird.
- Da die Temperatur tendenziell absolut Null nimmt, nimmt die atomare Schwingung fast vollständig ab.
Dann bildet das Glas eine einzige mögliche Konfiguration oder Mikro -Statement W = 1, Und deshalb entspricht die Entropie Null:
S = k ln (1) = 0
Aber nicht so lange wie ein Material, das in der Nähe des absoluten Nulls gekühlt ist. Dies geschieht nur, wenn der Kühlprozess sehr langsam und reversibel ist.
Andernfalls würden Faktoren wie im Glas vorhandene Verunreinigungen das Vorhandensein anderer Mikrostatten ermöglichen. Daher wäre W> 1 und Entropie größer als 0.
Restentropie
Wenn der Kühlprozess abrupt ist, durchläuft das System eine Abfolge von Nicht -Balance -Zuständen, was zu dem Material führt, um zu zeigen. In diesem Fall gibt es keine kristalline und ordentliche Struktur, sondern einen amorphen Feststoff, dessen Struktur der einer Flüssigkeit ähnlich ist.
In diesem Fall ist der minimale Entropiewert in der Nähe von absolutem Null nicht Null, da die Anzahl der Mikrostatten viel größer als 1 ist. Der Unterschied zwischen dieser Entropie und der Nullentropie des perfekten kristallinen Zustands ist als die bekannt Restentropie.
Die Erklärung lautet, dass das System unter einer bestimmten Schwellentemperatur keine andere Möglichkeit hat als eine Besetzung.
Es kann Ihnen dienen: Erstes Gesetz der Thermodynamik: Formeln, Gleichungen, BeispieleSie werden für die Aufrechterhaltung einer konstanten Entropie verantwortlich sein, auch wenn die Temperatur weiterhin in Richtung absoluter Null hingeht.
Beispiele
Beispiel 1: Die absolute Null und die Unbestimmtheit von Heisenberg
Das Heisenberg -Indeterminitätsprinzip legt fest, dass die Unsicherheit in der Position und im Impuls eines Teilchens, beispielsweise in den Atomen eines kristallinen Netzwerks, nicht unabhängig vom anderen ist, sondern der folgenden Ungleichheit folgt:
Δx ≤ Δp ≥ h
Wo H Plancks Konstante ist. Das heißt, die Unsicherheit in der Position multipliziert mit der Unsicherheit im Impuls (Masse pro Geschwindigkeit) ist größer als die Planck -Konstante, deren Wert sehr klein ist, aber nicht Null: H = 6.63 x 10-3. 4 J · s.
Und was hat das Prinzip der Unsicherheit mit dem dritten Gesetz der Thermodynamik zu tun? Wenn die Position der Atome des kristallinen Netzwerks festgelegt und präzise ist (genau (Δx = 0) Dann kann die Geschwindigkeit dieser Atome zwischen 0 und unendlich einen Wert nehmen. Dies wird durch die Tatsache widerlegt, dass jede Bewegung der thermischen Agitation im absoluten Null.
Wenn wir das bei absoluter Temperaturen beginnen, ist die gesamte Agitation nicht mehr auf dem Laufenden, und der Impuls jedes Atoms des Netzwerks ist genau Null (Δp = 0), dann würde das Unsicherheitsprinzip von Heisenberg implizieren, dass die Unbestimmtheit in den Positionen jedes Atoms unendlich wäre, dh sie können in jeder Position sein.
Infolge der vorherigen Aussage würde die Anzahl der Mikrostatten zu Unendlichkeit tendieren und Entropie würde auch einen unbestimmten Wert erfordern.
Beispiel 2: Superfluidität und der seltsame Fall von Helium-4
In Überflußer, die bei sehr niedrigen Temperaturen auftritt, verliert die Materie zwischen ihren Molekülen, genannt Schmiere. In diesem Fall könnte die Flüssigkeit für immer ohne Reibung zirkulieren, aber das Problem liegt bei diesen Temperaturen, dass fast nichts flüssig ist, außer Helium.
Helium und Helium 4 (sein am häufigsten vorkommender Isotop) bilden einen einzigartigen Fall, da das Helium bei dem atmosphärischen Druck und bei Temperaturen nahe an absolutem Null flüssig bleibt.
Wenn das Helium-4 bei einer Temperatur unter 2 eingereicht wird.2 K bei atmosphärischem Druck wird a überflüssig. Diese Entdeckung erfolgte 1911 in Leyden durch den niederländischen Physiker Heike Kamerlingh Onnes (1853-1926).
 Figur 3. Der niederländische Physiker Heike Kamerlingh Onnes (1853-1926). Quelle: Wikimedia Commons.
Figur 3. Der niederländische Physiker Heike Kamerlingh Onnes (1853-1926). Quelle: Wikimedia Commons. Helio-4-Atom ist ein Bosón. Bosonen sind im Gegensatz zu Fermionen Partikel, die den gleichen Quantenzustand einnehmen können. Daher treffen Bosonen Paulis Ausschlussprinzip nicht.
Dann alle Helium-4-Atome bei Temperaturen unter 2.2 K belegen den gleichen Quantenzustand und daher gibt es nichts weiter als eine einzige mögliche Mikrostata, was bedeutet, dass überflüssiges Helium-4 s = 0 hat.
Gelöste Übungen
- Übung 1
Betrachten Sie einen einfachen Fall, der aus einem System besteht, das nur aus drei Partikeln mit drei Energieniveaus besteht. Für dieses einfache System:
a) Bestimmen Sie die Anzahl der für drei Temperaturbereiche möglichen Mikrostata:
-hoch
-Halb
-Niedrig
b) Bestimmen Sie durch die Boltzmann -Gleichung Entropie in den verschiedenen Temperaturbereichen.
c) Diskutieren Sie die Ergebnisse und erklären Sie, ob das dritte Gesetz der Thermodynamik widerspricht oder nicht.
Lösung für
Auf einer molekularen und atomaren Skala werden die Energien, die ein System übernehmen kann. Wenn die Temperaturen so niedrig sind, haben die Partikel, aus denen das System besteht.
Es kann Ihnen dienen: Magnetische Induktion: Formeln, wie es berechnet wird und BeispieleHohe Temperatur
Wenn das System eine relativ hohe Temperatur aufweist, haben die Partikel genügend Energie, um alle verfügbaren Werte zu besetzen, was zu 10 möglichen Mikrostaten führt, die in der folgenden Abbildung erscheinen:
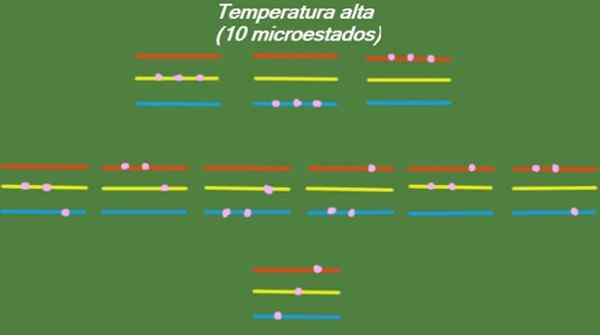 Figur 4. Mögliche Zustände bei hoher Temperatur für das Jahr 1 gelöst 1. Quelle: Vorbereitet von f. Zapata.
Figur 4. Mögliche Zustände bei hoher Temperatur für das Jahr 1 gelöst 1. Quelle: Vorbereitet von f. Zapata. Mittlere Temperatur
In dem Fall, dass das System eine Zwischentemperatur besitzt, haben die Partikel, die es ausmachen. Die möglichen Mikrostatten sind in der Abbildung dargestellt:
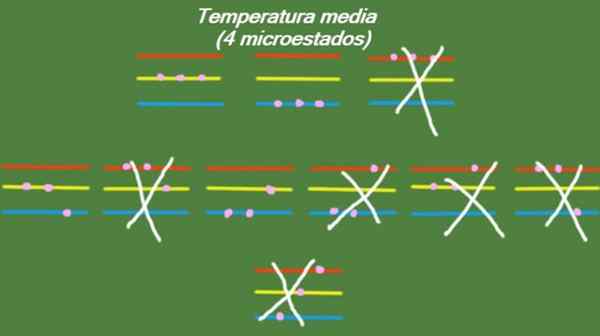 Abbildung 5. Mikrostaat bei durchschnittlicher Temperatur für das gelöste Trainingssystem 1. Quelle: Vorbereitet von f. Zapata.
Abbildung 5. Mikrostaat bei durchschnittlicher Temperatur für das gelöste Trainingssystem 1. Quelle: Vorbereitet von f. Zapata. Niedrige Temperatur
Wenn die Temperatur in unseren idealisierten drei Partikeln und drei Energieniveaus weiterhin abfällt, haben die Partikel so wenig Energie, dass sie nur das niedrigste Niveau belegen können. In diesem Fall gibt es nur 1 mögliche Mikrostata, wie in Abbildung 6 zu sehen ist:
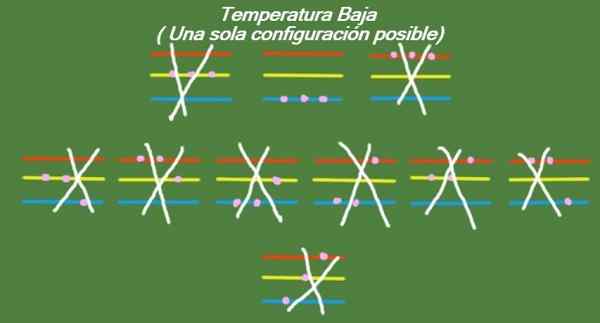 Abbildung 6. Bei niedriger Temperatur gibt es eine mögliche Konfiguration (eigene Ausarbeitung)
Abbildung 6. Bei niedriger Temperatur gibt es eine mögliche Konfiguration (eigene Ausarbeitung) Lösung b
Bereits bekannt die Anzahl der Mikrostatten in jedem Temperaturbereich, können wir bereits die zuvor angegebene Boltzmann -Gleichung verwenden, um die Entropie jeweils zu finden.
S = k ln (10) = 2.30 x k = 3.18 x 10-23 J/k (Hohe Temperatur)
S = k ln (4) = 1.38 x k = 1.92 x 10-23 J/k (Mittlere Temperatur)
Und schlussendlich:
S = k ln (1) = 0 (Niedrige Temperatur)
Lösung c
Erstens bemerken wir, dass die Entropie nach erwartungsvoller Temperatur abnimmt, wenn die Temperatur abfällt. Für die niedrigsten Temperaturwerte wird jedoch ein Schwellenwert erreicht, aus dem der Grundstatus des Systems erreicht ist.
Auch wenn die Temperatur so nah wie möglich bis absolut Null ist, sind keine kleineren Zustände verfügbar. Dann behält die Entropie ihren konstanten Mindestwert bei, dh in unserem Beispiel S = 0 ist.
Diese Übung zeigt auf der Ebene der Mikrostates eines Systems den Grund, warum das dritte Gesetz der Thermodynamik erfüllt ist.
- Übung 2
Grund, wenn die nächste Aussage wahr oder falsch ist:
"Die Entropie eines Systems bei der absoluten Temperatur Null ist genau Null".
Begründen Sie die Antwort und beschreiben Sie einige Beispiele.
Lösung
Die Antwort lautet: falsch.
Zunächst kann die absolute Temperatur nicht erreicht werden.
Es ist sehr wichtig zu beachten. Der Unterschied ist subtil, aber signifikant.
Das dritte Gesetz bestätigt nicht, dass die Entropie, wenn die Temperatur einen Wert willkürlich nahe an absoluter Null nimmt, auf Null tendiert. Dies würde nur im zuvor analysierten Fall geschehen: dem perfekten Kristall, bei dem es sich um eine Idealisierung handelt.
Viele mikroskopische Skalensysteme, dh auf Quantenskala, haben ihren Energiebasisniveau degenerieren, Was bedeutet die Existenz mehrerer Konfigurationen auf der niedrigsten Energieniveau.
Das Obige bedeutet, dass in diesen Systemen die Entropie niemals genau Null sein würde. Die Entropie wäre auch nicht genau Null in Systemen, die verweilen, wenn die Temperatur zu absolutes Null kommt. In diesem Fall die Restentropie Bevor man gesehen.
Dies liegt daran.
Verweise
- Cengel, und. 2012. Thermodynamik. 7. Ausgabe. McGraw Hill. 347.
- Jet Propulsion Laboratory. Der coolste Ort im Universum. Erholt von: Coldatomlab.Jpl.Topf.Regierung.
- González, a. Entropie und Spontanität. Erholt von: Geocities.WS
- Quora. Was ist der praktische Einsatz des dritten Gesetzes der Thermodynamik?. Erholt von: Quora.com
- Allgemeine Chemie. Dritter Prinzip der Thermodynamik. Erholt von: Korinth.PUCP.Edu.Sport
- Dritter Gesetz der Thermodynamik. Erholt von: YouTube.com
- Wikipedia. Entropiereste. Abgerufen von: in.Wikipedia.com
- Wikipedia. Dritter Gesetz der Thermodynamik. Abgerufen von: in.Wikipedia.com
- « Welche Unfälle treten bei kleinen Kindern und Erwachsenen am häufigsten auf?
- Tricloressigsäurestruktur, Eigenschaften, Synthese, Verwendungen, Effekte »

