Thermochemie

- 810
- 218
- Medine Kedzierski
Wir erklären, dass es sich um eine Thermochemie, welche Studien, seine Gesetze und Anwendungen handelt
 In der Thermochemie werden Wärmemodifikationen in chemischen Reaktionen untersucht
In der Thermochemie werden Wärmemodifikationen in chemischen Reaktionen untersucht Was ist Thermochemie?
Der Thermochemie Es ist verantwortlich für die Untersuchung der Wärmeveränderungen, die bei den Reaktionen zwischen zwei oder mehr chemischen Spezies durchgeführt werden. Es wird als wesentlicher Bestandteil der Thermodynamik angesehen, die die Transformation von Wärme und andere Energiearten untersucht, um die Richtung zu verstehen, in der die Prozesse entwickelt werden und wie seine Energie variiert.
Es ist auch wichtig zu verstehen, dass die Wärme die Übertragung von thermischer Energie beinhaltet, die zwischen zwei Körpern auftritt, wenn diese bei unterschiedlichen Temperaturen sind. Während thermische Energie mit der zufälligen Bewegung verbunden ist, die Atome und Moleküle besitzen.
Da fast alle chemischen Reaktionen durch Wärme absorbiert oder freigesetzt werden, ist die Analyse der durch Thermochemie auftretenden Phänomene sehr relevant.
Was untersucht die Thermochemie?
Die Thermochemie untersucht die Wärmeveränderungen in Form von Wärme, die bei chemischen Reaktionen auftreten oder wenn Prozesse, die physikalische Transformationen implizieren, auftreten.
In diesem Sinne müssen bestimmte Konzepte innerhalb des Subjekts geklärt werden, um das gleiche besser zu verstehen.
System
Zum Beispiel bezieht sich der Begriff "System" auf das spezifische Segment des Universums, das untersucht wird und als "Universum" die Berücksichtigung des Systems und seiner Umgebung verstanden wird (alles außerhalb davon).
Ein System besteht also im Allgemeinen aus den Arten, die an den chemischen oder physikalischen Transformationen beteiligt sind, die bei Reaktionen auftreten. Diese Systeme können in drei Typen eingeteilt werden: offen, geschlossen und isoliert:
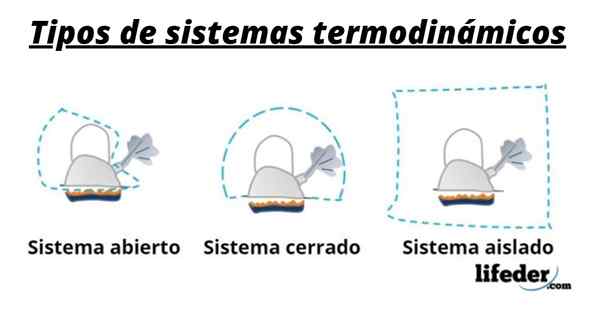
- Ein offenes System ermöglicht die Übertragung von Materie und Energie (Wärme) mit seiner Umgebung.
- In einem geschlossenen System gibt es einen Energieaustausch, aber nicht von Materie.
- In einem isolierten System wird die Übertragung von Materie oder Energie in Form von Wärme nicht vorgestellt. Diese Systeme werden auch als "adiabatisch" bezeichnet.
Thermochemiegesetze
 Germain Hess, Schöpfer des Hessgesetzes, grundlegend für die Thermochemie
Germain Hess, Schöpfer des Hessgesetzes, grundlegend für die Thermochemie Die Gesetze der Thermochemie sind eng mit Laplace und Lavoisiers Gesetz sowie dem Hessgesetz verbunden, die Vorläufer des ersten Gesetzes der Thermodynamik sind.
Das Prinzip der französischen Antoine Lavoizier (wichtiger chemischer und edler) und Pierre-Simon Laplace (berühmter Mathematiker, physikalischer und Astronomer) untersucht, dass „die Veränderung der Energie, die sich in einer physikalischen oder chemischen Transformation manifestiert Größe im Gegensatz zur Veränderung der Energie der umgekehrten Reaktion ".
Hessgesetz
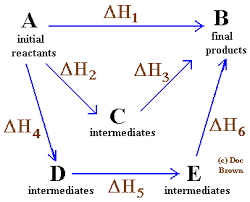
 Einfaches und allgemeines Diagramm, in dem das Hessgesetz für vier chemische Reaktionen angewendet wird
Einfaches und allgemeines Diagramm, in dem das Hessgesetz für vier chemische Reaktionen angewendet wird In der gleichen Reihenfolge der Ideen ist das vom russischen Chemiker aus der Schweiz, Germain Hess formulierte Gesetz, ein Eckpfeiler für die Erklärung der Thermochemie.
Dieses Prinzip basiert auf seiner Auslegung des Energieschutzgesetzes, das sich auf die Tatsache bezieht.
Das Hess -Gesetz kann auf diese Weise verkündet werden: "Die Gesamtenthalpie in einer chemischen Reaktion ist gleich, ob die Reaktion in einem einzigen Schritt durchgeführt wird, als ob es in einer Sequenz mehrerer Schritte auftritt".
Gesamtenthalpie tritt als Subtraktion zwischen der Summe der Enthalpie der Produkte mit Ausnahme der Summe der Enthalpie der Reaktanten auf.
Bei einer Änderung der Standardenthalpie eines Systems (unter Standardbedingungen von 25 ° C und 1 atm) kann es gemäß der folgenden Reaktion schematisiert werden:
Kann Ihnen dienen: ChlorogensäureΔHReaktion = Σδh(Produkte) - Σδh(Reaktanten)
Eine andere Möglichkeit, dieses Prinzip zu erklären und zu wissen, dass sich die Änderung der Enthalpie auf die Wärmeveränderung in den Reaktionen bezieht, wenn sie einem konstanten Druck vergeben werden folgt zwischen dem Anfangszustand und dem Ende.
Erstes Gesetz der Thermodynamik
Dieses Gesetz ist so intrinsisch mit der Thermochemie verbunden, dass es manchmal verwirrt ist, welches das andere inspiriert hat; Um diesem Gesetz Leuchten zu geben, muss man zunächst sagen, dass es auch seine Wurzeln im Prinzip der Energieerhaltung hat.
Damit die Thermodynamik nicht nur Wärme als eine Form der Energieübertragung (zODER).
Die Variation der internen Energie eines Systems (ΔU) ist also durch die Differenz zwischen seinen anfänglichen und endgültigen Zuständen angegeben (wie im Hessgesetz zu sehen).
Angesichts der Tatsache, dass interne Energie aus kinetischer Energie (Partikelbewegung) und potentieller Energie (Wechselwirkungen zwischen Partikeln) desselben Systems besteht.
Thermochemie -Anwendungen
Die Thermochemie hat mehrere Anwendungen, einige davon werden unten erwähnt:
- Bestimmung von Energieveränderungen in bestimmten Reaktionen durch die Verwendung von Kalorimetrie (Messung von Wärmeveränderungen in bestimmten isolierten Systemen).
- Abzug von Enthalpieänderungen in einem System, auch wenn sie nicht durch eine direkte Messung bekannt werden können.
- Analyse von Wärmeübertragungen, die experimentell erzeugt werden, wenn organometallische Verbindungen mit Übergangsmetallen gebildet werden.
- Untersuchung von Energietransformationen (in Wärme), die in Koordinationsverbindungen von Polyaminen mit Metallen verabreicht werden.
- Bestimmung der Enthalpien des Metall-Sauerstoffverbindung von β-DICs und β-DICs, die mit Metallen vereint sind.
- Neben früheren Anwendungen kann die Thermochemie verwendet werden, um eine große Anzahl von Parametern zu bestimmen, die mit anderen Arten von Energie- oder Zustandsfunktionen verbunden sind, die den Status eines Systems zu einem bestimmten Zeitpunkt definieren.
- Die Thermochemie wird auch in der Untersuchung zahlreicher zusammengesetzter Eigenschaften verwendet, wie bei der Titrationskalorimetrie.
Verweise
- Wikipedia. (S.F.). Thermochemie. Abgerufen von.Wikipedia.Org
- Chang, R. (2007). Chemie, neunte Ausgabe. Mexiko: McGraw-Hill.
- Librettexts. (S.F.). Thermochemie - eine Überprüfung. Erhalten von chem.Librettexts.Org
- Tyagi, p. (2006). Thermochemie. Aus Büchern erholt.Google.CO.gehen
- Ribeiro, m. ZU. (2012). Thermochemie und ihre Anwendungen auf chemische und biochemische Systeme. Aus Büchern erhalten.Google.CO.gehen
- Singh, n. B., Das, s. S., Und Singh,. K. (2009). Physikalische Chemie, Band 2. Aus Büchern erholt.Google.CO.gehen

