Tiolen
- 2190
- 618
- Medine Kedzierski
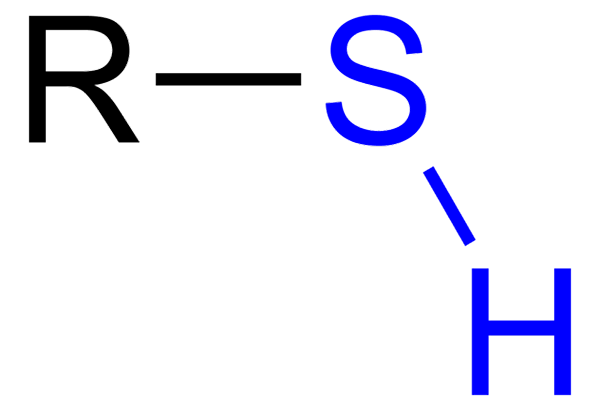
Der Tiolen Es sind organische Verbindungen, die eine SH -Gruppe haben, die als Tiol- oder Sulfihydrilo -Gruppe bezeichnet wird. Seine allgemeine Formel ist RSH, die R für eine Miete, eine Aryl- oder andere chemische Gruppe darstellen kann. Das charakteristische Merkmal von Thioles ist sein starker stinkender Geruch.
Einige Thiolen werden verwendet, um ihren Geruch von brennbaren Gasen zu vermitteln, um eine Leckage dieser Gase zu erkennen, die angesichts ihrer Merkmale von großer Gefahr sein kann. Tiolen ähneln Alkoholen, da sie eine OH -Gruppe haben, während die Thioles a sh.
 Tiol mit blauer Sulfhydrillo -Gruppe
Tiol mit blauer Sulfhydrillo -Gruppe Sie haben jedoch wiederum verschiedene Unterschiede: Die OH -Gruppe ist polarer als die SH -Gruppe, und Schwefel ist ein kleineres Atom als Sauerstoff und weniger elektronegativ.
Dies bestimmt, dass Thioles -Moleküle keine Wasserstoffbrückenbindungen oder Wasser oder unter ihnen bilden. Daher ist die Löslichkeit von Thiolen im Wasser niedrig und sein Siedepunkt niedriger als die von Alkoholern mit einer Kette ähnlicher Kohlenstoffe.
Tiolen sind besonders nützlich und in biochemischen Systemen häufig, da einige Biomolekülen wie Coenzym an entsprechen. Die S-H-Bindung ist saurer als O-H, leichter zu brechen und auch leichter zu ersetzen oder andere molekulare Fragmente in zahlreichen Schwefel organischen Synthese zu ersetzen oder zu ersetzen.
[TOC]
Tioles Eigenschaften
 Das stinkende Aroma der Ausläufer besteht hauptsächlich aus Thiolen
Das stinkende Aroma der Ausläufer besteht hauptsächlich aus Thiolen Allgemeinheiten
Die OH -Gruppe von Alkoholern und die SH -Gruppe der Tiolen hat eine Reihe physikalischer und chemischer Eigenschaften für Sauerstoff und Schwefel derselben chemischen Gruppe der Periodenzüchter (über Gruppe).
Loa Tioéters, Uniocetals und Thioéster, die zu chemischen Verbindungen sind, die von Alkoholen wie Ether, Acetalen und Estern gebildet werden. S-H- und O-H-Verbindungen bieten jedoch einige Unterschiede, die sich in den Eigenschaften von Thiolen und Alkoholen widerspiegeln werden.
Geruch
Ein Merkmal von Thiolen mit niedrigem Molekulargewicht ist sein unangenehmer Geruch, ähnlich wie Knoblauch und Zwiebel. Dieser Geruch hat eine solche Größe, dass der menschliche Geruch eine Schwelle von einem Teil des Thiols für zehn Milliarden Teile Luft hat.
Etanotiol wird Erdgas als Sicherheitsmaßnahme hinzugefügt, um alle brennbaren, aber Toilettenflucht selbst zu erkennen. Der Geruch von Thiolen nimmt ab, indem die Anzahl der Kohlenstoffe ihrer Kette erhöht wird, da die Volatilität und der Anteil des TIL -Schwefels abnimmt.
Kann Ihnen dienen: Ammoniumphosphat: Struktur, Eigenschaften, erhalten, verwendet, verwendetSiedepunkt und Löslichkeit
Die S-H-Verbindung der Thioles hat einen Dipolmoment weniger als die O-H-Verbindung der Alkohole. Darüber hinaus ist das Schwefelatom kleiner und kleiner als das Sauerstoffatom.
Dies bestimmt, dass Thioles -Moleküle keine Wasserstoffbrückenbindungen mit Wasser oder unter ihnen bilden können, was einen Unterschied zwischen den physikalischen Eigenschaften von Thiolen und Alkoholen verursacht. Zum Beispiel: Metanotiol (Cho3SH) hat einen Siedepunkt von 6 ° C, während Methanol (Cho3OH) kocht bei 65 ° C.
Daher ist bei Raumtemperatur (25 ºC) Methanol eine Flüssigkeit und Metanotiol ist ein Gas.
Zusammenfassend: Thiolen haben einen niedrigeren Siedepunkt als die entsprechenden Alkohole. Aus den gleichen Gründen ist die Löslichkeit von Thiolen im Wasser und in anderen polaren Lösungsmitteln sehr niedrig. Inzwischen sind Alkohole mit niedrigem Molekulargewicht sehr löslich im Wasser.
Reaktivität
Die S-H-Verbindung ist schwächer als die O-H-Bindung, also dissoziiert S-H leichter und macht Thiole starke Säuren als Alkohole. Die meisten Alkohole haben eine PKA zwischen 16 und 18, während Thiolen eine PKA um 11 haben.
Dies erlaubt Thiolen-): Ein sehr starkes nukleophiles Mittel.
Die SH-Gruppe kann oxidieren, um Disulfideverbindungen (-s-S-) zu bilden, die in der glutathionischen Oxidation vorhanden sind: ein in den Zellen vorhanden.
Bromo oder andere Halogene sowie Sauerstoff können auf ein Thiol wirken, um Disulfurbrücken zu bilden:
2 RSH +Br → R-S-R '+2 HBR
RSSR -Verbindungen sind als organische Sulfide und Alkiiles bekannt, r2S.
Andererseits können starke Oxidationsmittel wie Natriumhypochlorit und Wasserstoffperoxid auf Thiole wirken, um Sulfonsäuren zu verursachen:
Rsh +h2ENTWEDER2 → RSO3H +3 h2ENTWEDER
Nomenklatur
Die IUPAC -Nomenklatur für Thioles ist dem von Alkohols sehr ähnlich: der Name des Alkano, aus dem das Suffix 'Tiol' hinzugefügt wird.
Somit wird zum Beispiel der von Stano abgeleitete Distan als 1-Butanotiol genannt, CH3CH2CH2CH2SH, was mit der Anzahl der Position der SH -Gruppe in den Kohlenstoffen der Kette anzeigt.
Kann Ihnen dienen: Kation: Training, Unterschiede zu Anion und BeispielenEbenso gibt es wieder eine weitere Nomenklatur, ähnlich dem von Alkoholen: Das Wort "Alkohol" wird durch "Mercaptan" in den Namen von Alkohols ersetzt. Zum Beispiel Cho3Sh, analog zu Methylalkohol, CH3Oh, heißt Methyl oder Mercaptan Mercaptan.
Ein weiteres Beispiel wäre Cho3CH2Ch (sh) ch3, genannt 2-Butanotiol, sekbutiler Kaufmann oder Waren Secbutil. Das heißt, der Schwerpunkt wird auf die Identität von R in der RSH -Formel gelegt. Daher werden auch die anderen Nomenklaturnormen für Alkohole für Thiolen erfüllt.
Und schließlich, wenn die SH -Gruppe in einer größeren Struktur vorhanden ist oder die wichtigsten Gruppen vorherrschen, wird das Sulfihydrilo- oder Mercapto -Präfix verwendet.
Zum Beispiel zusammengesetzte CH3CH2CH (SH) COCH3 Es heißt 3-Mercapto-2-Penona. Beachten Sie, dass die SH weniger Priorität hat als sauerstoffhaltige Gruppen (mit Ausnahme des Ethers), so.
Synthese
Eine Methode der Synthese von Thiolen besteht aus der Reaktion der Tiota mit einem Alkylhalogenid, das ein Zwischensalz von Isotiouron erzeugt. Dies wird durch Natriumhydroxid hydrolysiert, um Thiol und Harnstoff zu erhalten.
Das CH3SH wird industriell durch Reaktion von Wasserstoffsulfid mit Methanol in Gegenwart von Säurekatalysatoren hergestellt:
CH3Oh +h2S → Ch3Sh +h2ENTWEDER
In einer anderen Produktionsmethode wird ein Alkylhalogenid mit Natriumhydrosulfuro umgesetzt:
RX +NASH → RSH +NAX
Anwendungen
Enzymfixierung, die mit Nanopartikeln verbunden ist
Tiolen werden als Brücken verwendet, um Nanopartikula-Enzymkomplexen zu Goldelektroden zu verbinden. Zum Beispiel werden Thiolen zur Fixierung des Nanopartikel-Uricasa-Komplexes verwendet, einem Enzym, das in der Umwandlung von Harnsäure in Allantoin eingreift.
Tiol -No -Reaktion
Es ist eine organische Reaktion zwischen einem Tiol und einem Alken, der eine "Klick" -Reaktion nennt. Dass es unter anderem eine Hochleistungsreaktion ist, ein breites Umfang, der durch nicht -chromatographische Methoden eliminierbar ist, und das ist auch einfach zu durchführen.
Die Thiol -NO -Reaktion hat Anwendungen in der Synthese von Tioazúcar: Zucker in Salicinol vorhanden, einem α -Glycosidase -Inhibitor. Salicinol wurde aus Pflanzen isoliert, die in Sri Lanka und Indien bei der Behandlung von Diabetes verwendet werden.
Darüber hinaus wird die Thiol -No -Reaktion in der Chemie von Kohlenhydraten, Polymerisationen, Oberflächenchemie, Synthesechemie und Chemie von Peptiden verwendet.
Kann Ihnen dienen: Gefrierpunkt: So berechnen Sie es und BeispieleGeruchsmittel
 Das Küchengas ist Toilette, aber dank der Zusammensetzung von Thiolen mit niedrigem Molekulargewicht hat es einen charakteristischen Geruch
Das Küchengas ist Toilette, aber dank der Zusammensetzung von Thiolen mit niedrigem Molekulargewicht hat es einen charakteristischen Geruch Aliphatische Thiole mit niedrigem Molekulargewicht werden in Erdgase eingebaut, so dass ihr starker Geruch angesichts einer Flucht oder Leckage von Gas als Warnung dient.
Medizin
Penicilamin (c5HelfNEIN2S) Es ist ein Medikament, das bei der Behandlung von Wilson -Krankheit und rheumatoider Arthritis verwendet wird.
Und der Captopril (c)9HfünfzehnNEIN3S) Andererseits wird es bei der Behandlung von arterieller Hypertonie und bei Herzkrankheiten angewendet.
Beide sind Beispiele für Thiolen mit medizinischen Anwendungen.
Biologisch
Tioles -Gruppen sind unter anderem mit biologischer Funktion in Cystein, Coenzym A und Glutathion vorhanden.
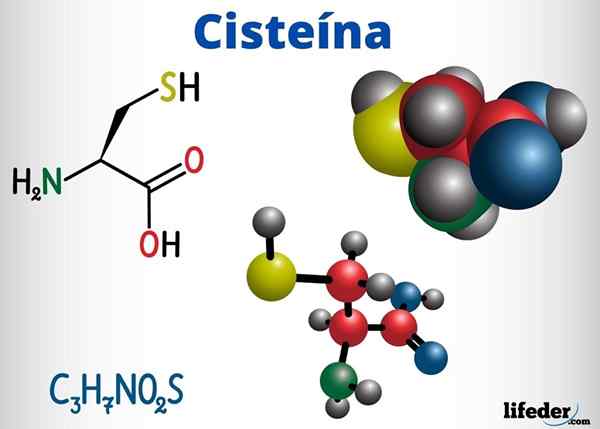
Cystein ist eine Aminosäure, die Disulfurbrücken in ihrer Proteinkette bilden kann, die daher für die Tertiärstruktur eines Proteins verantwortlich ist. Es kann auch Disulfurbrücken zwischen verschiedenen Proteinketten bilden, was die quaternäre Struktur von Proteinen verursacht.
Cystein befindet sich in den aktiven Zentren zahlreicher Enzyme und hat auch eine antioxidative Wirkung.
Glutathion ist eine sehr wichtige antioxidative intrazelluläre Wirkung, die Zellen und Makromolekülen, die es zusammensetzen, Schutz verleihen.
Das Coenzym A ist dagegen ein Thiol, das in die Synthese und Oxidation von Fettsäuren interveniert. Darüber hinaus greift Coenzym in Form von Acetylcoenzym A zu Beginn des Zitronensäurezyklus oder Krebszyklus ein.
Beispiele
Schließlich werden einige Namen von Thiolen begleitet von ihren molekularen Formeln aufgeführt:
-Tioessigsäure (C2H4DU)
-Coenzym A (C. CeinundzwanzigH36N7ENTWEDER16P3S)
-Reduzierte Glutation (c10H17N3ENTWEDER6S)
-Cystein (c3H7NEIN2S)
-Mercaptanol (c2H6DU)
-Metanotiol (Ch3SCH)
-1-Propanotiol (c3H7SCH)
-Butanotiol (c4H 9SCH)
-Tiofenol oder Tiomerosal (C6H6S)
-Pomelo Mercaptano (C10H18S)
-Hexadecanotiol (c6H3. 4S)
-Penicillamin (c6HelfNEIN2S)
-Captopril (c9HfünfzehnNEIN3S)
-Etanotiol (c2H6S)
-2-Propenetiol (c3H6S)
-Α-Lipoikum oder Lipoamid (C8H14ENTWEDER2S2). Es ist eine zyklische Disulfid.
Verweise
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. (10th Auflage.). Wiley Plus.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Morrison und Boyd. (1987). Organische Chemie. (Fünfte Ausgabe). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Thiol. Abgerufen von: in.Wikipedia.Org
- DR. Dietmar Kennepohl et al. (13. September 2020). Thiole und Sulfide. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Die Herausgeber von Enyclopaedia Britannica. (2020). Thiol. Erholt von: Britannica.com
- Nolan MD und Scanlan EM (2020) Anwendungen der Thiol-enge Chemie für die Peptidwissenschaft. Vorderseite. Chem. 8: 583272. Doi: 10.3389/fchem.2020.583272
- DR. Carl c. Wamser. (1999). Kapitel 9: Alkohole und Thiole. Abgerufen von: Web.PDX.Edu

