Arten von Batterien, Eigenschaften und Reaktionen

- 4305
- 1056
- Ivan Pressler
Auf dem Markt können Sie anders bekommen Arten von Batterien mit ihre Caracteristics eigen. Die Batterien, die nichts anderes als Voltaic -Zellen sind, bieten dem Verbraucher den Vorteil, an einem Ort einzunehmen (sofern die Bedingungen nicht drastisch sind).
Im Allgemeinen können Batterien isoliert gekauft werden; Sie sind aber auch in Serie oder Parallel miteinander verbunden, dessen Set das ist, was sie als Batterien bezeichnen. Und so werden die Begriffe "Batterien" und "Batterien" normalerweise wahllos verwendet, auch wenn sie nicht gleich sind.
 Alkalische Batterien: Eine der bekanntesten Arten von Batterien
Alkalische Batterien: Eine der bekanntesten Arten von Batterien Die Batterien können unzählige Farben, Formen und Größen haben, wie es aus anderen Materialien besteht. Auch und vor allem ihre innere Struktur, bei der chemische Reaktionen, die Strom erzeugen, entwickelt, dient dazu, sie voneinander zu unterscheiden.
Zum Beispiel sind drei alkalische Batterien, eine der häufigsten, im oberen Bild gezeigt. Der Begriff Alkalin bezieht sich auf die Tatsache, dass das Medium, in dem die Freisetzung und der Elektronenfluss auftreten, grundlegend ist; Das heißt, es hat einen pH -Wert von mehr als 7 und die OH -Anionen vorherrschen- und andere negative Gebühren.
[TOC]
Pilas -Klassifizierung
Bevor Sie sich mit einigen der verschiedenen Arten von Batterien befassen, müssen diese weltweit als primär oder sekundär eingestuft werden.
- Primärbatterien
Primärbatterien sind diejenigen, die nach dem Verbrauch verworfen oder recycelt werden müssen, da die chemische Reaktion, auf die der elektrische Strom aufrechterhalten wird, irreversibel ist. Daher können diese nicht aufgeladen werden.
Sie werden hauptsächlich in Anwendungen verwendet, bei denen es unpraktisch ist, elektrische Energie aufzuladen. wie auf militärischen Geräten mitten auf dem Schlachtfeld. Sie sind auch für Geräte ausgelegt, die wenig Energie verbrauchen, so dass sie länger dauern. Zum Beispiel Fernbedienungen oder tragbare Konsolen (Gameboy, Tetris und Tamagotchi).
Alkalische Batterien, um ein anderes Beispiel zu zitieren, gehören auch zum Primärtyp. Sie haben normalerweise zylindrische Formen, obwohl dies nicht bedeutet, dass zylindrische Batterien nicht sekundär oder wiederaufladbar sein können.
- Sekundärbatterien
Im Gegensatz zu Primärbatterien können sekundäre Batterien aufgeladen werden, sobald ihnen die Energie ausgeht.
Dies liegt daran.
Einige sekundäre Batterien (Batterien genannt) sind normalerweise klein, ebenso wie primär; Sie werden jedoch Geräten zugeordnet, die mehr Energie verbrauchen und für die die Verwendung von Primärbatterien wirtschaftlich und energisch sein würde. Zum Beispiel enthalten Handys Batterien Sekundärbatterien.
Außerdem sind Sekundärbatterien für große Geräte oder Schaltkreise ausgelegt. Zum Beispiel Autobatterien, die aus mehreren Batterien oder Voltaikzellen bestehen.
Sie sind normalerweise teurer als Primärbatterien und Batterien, aber für langfristige Verwendungszwecke sind sie eine angemessenere und effektivere Option.
- Andere Aspekte
Die Batterien werden entweder in primär oder sekundär klassifiziert; Aber kommerziell oder im Volksmund werden sie normalerweise gemäß der Form (zylindrisch, rechteckig, Schaltflächen) zu dem vorgesehenen Gerät (Kameras, Fahrzeuge, Taschenrechner), zu ihren Namen (AA, AAA, C, D, N, A23 usw. .) Und zu seinen IEC- und ANSI -Codes.
Es kann Ihnen dienen: Pyridin: Struktur, Eigenschaften, Verwendung, Toxizität, SyntheseAuch Merkmale wie seine Spannung (1,2 bis 12 Volt) sowie ihre Nutzungsdauer und Preise sind dafür verantwortlich, eine bestimmte Klassifizierung in den Augen des Verbrauchers zu verleihen.
Stapeltypliste
- Kohlenstoff-Zink-Batterien
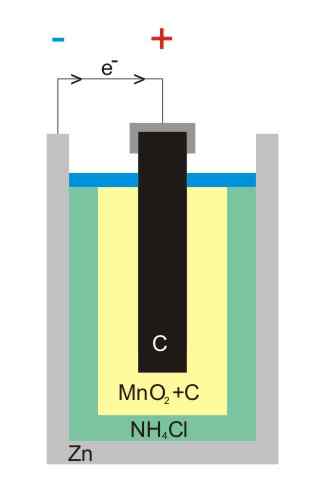 Zink-Kohlenstoff-Batterie-Illustration
Zink-Kohlenstoff-Batterie-Illustration Kohlenstoff-Zink-Batterien (auch als Leclanché- oder Salinas-Pilas-Zellen bekannt) sind eine der primitivsten und werden derzeit vor anderen Batterien als fast stillgelegt. Vor allem vor den alkalischen Batterien, die zwar etwas teurer sind, haben sie jedoch eine Lebenszeit und große Spannungen.
Wie der Name schon sagt, bestehen seine Elektroden aus einer Dose Zink und einer Graphitstange, die der Anode bzw. der Kathode entspricht.
In der ersten Elektrode entsteht die Anode durch Oxidation des metallischen Zinkes die Elektronen. Diese Elektronen fahren dann eine externe Schaltung, die das Gerät mit Strom versorgt, und enden dann in der Graphit -Kathode, wo der Zyklus abgeschlossen ist, wenn das Mangandioxid reduziert wird, in dem es eingetaucht ist.
Reaktionen
Die chemischen Gleichungen für die Reaktionen, die in den Elektroden auftreten, sind:
Zn (s) → Zn2+(Ac) + 2e- (Anode)
2 Mno2(s) + 2e- + 2 NH4Cl (ac) → mn2ENTWEDER3(s) + 2 nh3(Ac) + h2Oder (l) + 2 cl- (AC) (Kathode)
Diese Batterien sind dem Alkalin sehr ähnlich: Beide sind zylindrisch (wie die des Bildes). Es können jedoch Kohlenstoff-Zink-Batterien unterschieden werden, wenn die im Ausland beschrifteten Eigenschaften im Detail gelesen werden oder wenn Ihr IEC-Code den Buchstaben R vorangetrieben wird. Seine Spannung beträgt 1,5 V.
- Alkali-Batterien
Alkalische Batterien sind denen des Carbon-Zink-Typs sehr ähnlich, mit dem Unterschied, dass das Medium, in dem die Elektroden OH-Anionen enthalten-. Dieses Medium besteht aus starken Elektrolyten von Kaliumhydroxid, KOH, was zum OH beiträgt- das beteiligt und "zusammenarbeiten" an der Migration von Elektronen.
Es kommt in verschiedenen Größen und Spannungen, obwohl das häufigste 1,5 V ist. Sie sind vielleicht die bekanntesten Batterien auf dem Markt (zum Beispiel Duracell).
Die Reaktionen, die in ihren Elektroden auftreten, sind:
Zn (s) + 2OH- -(aq) → zno (s) + h2Oder (l) + 2e- - (Anode)
2Mn2(s) + h2Oder (l) + 2e- - → mn2ENTWEDER3(s) + 2OH- -(aq) (Kathode)
Wenn die Temperatur zunimmt, treten die Reaktionen immer schneller und schneller auf. Interessanterweise wurden beliebte Gerüchte durchgeführt, um sie in den Gefrierschrank zu bringen, um ihre Lebensdauer zu erhöhen. Aber beim Abkühlen kann sein Inhalt mögliche Einfestigkeiten erleiden, die weitere Mängel oder Risiken mit sich bringen.
Quecksilber
 Wahrscheinliche Quecksilberbatterie, die mit der Silberoxidbatterie verwechselt werden kann. Quelle: Multicherry [CC0].
Wahrscheinliche Quecksilberbatterie, die mit der Silberoxidbatterie verwechselt werden kann. Quelle: Multicherry [CC0]. Quecksilberbatterien sind aufgrund ihrer besonderen Schande von Silberknöpfen sehr charakteristisch (überlegenes Bild). Fast jeder würde sie auf den ersten Blick erkennen. Sie sind auch alkalisch, aber ihre Kathode enthält zusätzlich zu Graphit- und Mangan -Dioxid, Quecksilberoxid, HGO; was nach der Reduzierung metallischer Quecksilber wird:
Zn (s) + 2OH-(Ac) → zno (s) + h2Oder (l) + 2e-
Hgo (s) + h2O + 2e- → Hg (s) + 2OH-
Kann Ihnen dienen: Magnesiumoxid: Struktur, Eigenschaften, Nomenklatur, verwendetBeachten Sie, wie bei diesen Zellreaktionen die OH -Anionen konsumiert und regeneriert werden-.
Als kleine Batterien ist es für kleine Artefakte wie Uhren, Taschenrechner, Spielzeugsteuerungen usw. bestimmt. Wer eines dieser Objekte verwendet hat, hat bemerkt, dass es nicht notwendig ist, die Batterien für fast eine "Ewigkeit" zu ändern. das wäre 10 Jahre alt, ungefähr.
Silberoxid
 Silberoxidbatterien. Quelle: Lukas A, Cze [Public Domain].
Silberoxidbatterien. Quelle: Lukas A, Cze [Public Domain]. Der Hauptdefekt von Quecksilberbatterien besteht darin, dass sie aufgrund der toxischen Eigenschaften des Metalls, wenn sie verworfen werden, ein ernstes Problem für die Umwelt darstellen. Vielleicht fehlt dies fehlen IEC- und ANSI -Codes. Für Silberoxidbatterien geht der IEC -Code im Buchstaben s voraus.
Einer der Ersatzstoffe für Quecksilberbatterien entspricht der von Silberoxid, viel teurer, aber weniger ökologischer Auswirkungen (überlegenes Bild). In seinen Anfängen enthielten sie Quecksilber, um das Zink vor alkalischen Korrosion zu schützen.
Es ist mit einer Spannung von 1,5 V erhältlich, und seine Anwendungen sind denen des Quecksilberpila sehr ähnlich. In der Tat sehen beide Batterien auf den ersten Blick identisch aus. Obwohl es möglicherweise viel größere Silberoxidbatterien geben kann.
Die Reaktionen in ihren Elektroden sind:
Zn (s) + 2OH- -(AC) → Zn (OH)2(s) + 2 e- -
Ag2Oder (s) + 2h+(Ac) + 2e- - → 2AG (s) + h2Oder (l)
Wasser leidet anschließend an Elektrolyse und zersetzt sich auf H -Ionen+ und oh-.
Beachten Sie, dass es anstelle von Quecksilber in der Metall -Silberkathode gebildet wird.
- Nickel-Cadmium-Pilas (Nicad)
 NICD -Batterie. Quelle: Lordider [CC0].
NICD -Batterie. Quelle: Lordider [CC0]. Ab diesem Zeitpunkt werden Sekundärbatterien oder Batterien berücksichtigt. Wie Quecksilber sind Nickel-Cadmium-Batterien durch Cadmium-Metall für die Umwelt (für Fauna und Gesundheit) schädlich.
Sie sind durch Erzeugen hoher elektrischer Ströme charakterisiert, und eine große Anzahl von Male kann wieder aufgeladen werden. Tatsächlich kann das 2000 Mal wieder aufgeladen werden, was der außergewöhnlichen Haltbarkeit entspricht.
Seine Elektroden bestehen aus Nickeloxidhydroxid, Kind (OH) für die Kathode und metallischem Cadmium für die Anode. Die chemische Fundament bleibt im Wesentlichen gleich: Cadmium (anstelle von Zink) verliert Elektronen und Cadmium nio (OH) gewinnt sie.
Die semikierten Reaktionen sind:
CD (s) + 2OH-(AC) → CD (OH)2(s) + 2e-
2nio (OH) (S) + 2H2Oder (l) + 2e- → 2ni (OH)2(s) + oh-(Ac)
Oh Anionen-, Wieder kommen sie aus dem Koh -Elektrolyten. Nicad -Batterien erzeugen dann Nickel- und Cadmium -Metallhydroxide.
Sie werden einzeln oder in Paketen verwendet (wie gelbes, überlegenes Bild) gekoppelt oder in Paketen gekoppelt). Sie kommen dann in großen oder kleinen Paketen. Die Kleinen finden in Spielzeug verwendet; Aber die großen sind für Flugzeuge und Elektrofahrzeuge bestimmt.
- Nickel-Hydro-Metallic Pilas (Ni-HM)
 Ni-HM-Batterien. Quelle: ramsh ng von flickr (https: // www.Flickr.com/fotos/rameshng/5645036051)
Ni-HM-Batterien. Quelle: ramsh ng von flickr (https: // www.Flickr.com/fotos/rameshng/5645036051) Eine weitere bekannte Batterie oder Batterie, die Nicads in Energiekapazitäten übertrifft, ist NI-HM (Nickel und Metallic Hydrid). Es kann im zylindrischen Format (herkömmliche Batterien, überlegenes Bild) oder in einer Batterie gekoppelt sein.
Chemisch vorhanden fast die gleichen Eigenschaften wie Nicad -Batterien, wobei der Hauptunterschied in ihrer negativen Elektrode basiert: Die Kathode ist nicht Cadmium, sondern einer intermetallischen Legierung von Seltenen Erden und Übergangsmetallen.
Kann Ihnen dienen: Rotary Trockner: Betrieb, Wofür es ist, Teile, AnwendungenDiese Legierung ist für die Absorption von Wasserstoff verantwortlich, die während der Last gebildet werden und ein komplexes Metallhydrid erzeugt (daher der Buchstabe H in seinem Namen).
Ni-HM-Batterien liefern zwar mehr Energie (ungefähr 40% mehr), tragen zwar teurer, tragen jedoch schneller und können nicht die gleiche Anzahl von Malen wie Nicad-Batterien neu geladen werden. Das heißt, sie haben eine niedrigere Lebensdauer der Nutzungsdauer. Es fehlt ihnen jedoch der Speichereffekt (Verlust der Batterieleistung, indem sie nicht vollständig entlassen werden).
Aus diesem Grund sollten sie nicht in Maschinen verwendet werden, die langfristig arbeiten. Obwohl dieses Problem mit den LSD-NIHM-Batterien gepackt wurde. Ebenso haben NI-HM-Batterien oder Batterien sehr stabile thermische Eigenschaften, die in einem weiten Temperaturbereich betrieben werden können, ohne ein Risiko darzustellen.
Reaktionen
Die Reaktionen, die in ihren Elektroden auftreten, sind:
Ni (OH)2(s)+ oh- -(ac) ⇌ nio (oh) (s) + h2Oder (l) + e- -
H2Oder (l) + m (s) + e- - ⇌ Oh- -(ac)+ mh (s)
- Ion-Litio-Batterien
 Lithium-Ionen-Batterie eines Laptops. Quelle: Kristoferb von Wikipedia.
Lithium-Ionen-Batterie eines Laptops. Quelle: Kristoferb von Wikipedia. In den Batterien und Lithiumbatterien basieren sie auf der Migration der Li -Ionen+, die von der Anode auf die Kathode übertragen werden, Produkte elektrostatischer Abstoßungen durch die wachsende positive Ladung.
Einige können aufladen, wie Laptop -Batterien (überlegenes Bild) und andere zylindrisch und rechteckig (glatt2, Lisocl2 oder limo2) NEIN.
Ion-Litio-Batterien zeichnen sich durch sehr Licht und Energie aus, wodurch sie in vielen elektronischen Geräten wie Smartphones und medizinischer Geräte verwendet werden können. Sie leiden auch kaum unter dem Speichereffekt, ihre Lastdichte übersteigt die von Nicad- und NI-HM-Batterien und -batterien und verzögert mehr beim Herunterladen.
Sie sind jedoch sehr empfindlich gegenüber hohen Temperaturen, sogar explodieren. Und außerdem sind sie vor anderen Batterien normalerweise teurer. Trotzdem sind Lithiumbatterien auf dem Markt mit guten Augen zu sehen, und viele Verbraucher qualifizieren sie als die besten.
- Säure -Blei -Batterien
 Typische Carbauto -Batterie Batterie. Quelle: Tntflash [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Typische Carbauto -Batterie Batterie. Quelle: Tntflash [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Und schließlich enthält saure Bleibakterien, wie der Name schon sagt- aber h+; insbesondere eine konzentrierte Lösung von Schwefelsäure. Voltaic -Zellen befinden sich in ihren Boxen (oberes Bild), wo drei oder sechs von ihnen in Reihe gekoppelt werden können, was eine Batterie von 6 bzw. 12 V ergibt.
Es ist in der Lage, große Mengen an elektrischer Ladung zu erzeugen, und da sie sehr schwer sind, sind sie für Anwendungen oder Geräte bestimmt, die nicht manuell transportiert werden können. Zum Beispiel Autos, Sonnenkollektoren und U -Boote. Diese Säure -Batterie ist die älteste und ist in der Automobilindustrie immer noch in Kraft.
Ihre Elektroden bestehen aus Blei: PBO2 Für die Kathode und eine schwammige metallische Blei für Anode. Die Reaktionen, die in ihnen auftreten, sind:
Pb (s) +hso- -4(aq) → PBSO4(s) +h+(aq) + 2e- -
Pbo2(s) +HSO- -4(aq) + 3h+(aq) + 2e- - → PBSO4(s) + 2h2Oder (l)
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Odunlade Emmanuel. (24. Juli 2018). Verschiedene Arten von Batterien und Anwendungen. Schaltkreis Digest. Wiederhergestellt von: Circuitdigest.com
- PRBA. (S.F.). Arten von Batterien. Erholt von: PRBA.Org
- Isidor Buchman. (2019). Was ist die beste Batterie?? Battery University. Abgerufen von: Batterieuniversität.com
- Die McGraw-Hill-Unternehmen. (2007). Kapitel 12: Batterien. [PDF]. Erholt von: Oakton.Edu
- Shapley Patricia. (2012). Häufige Batterie -Typen. Universität von Illinois. Erholt von: Butan.Chem.UIUC.Edu
- Ökologische Haltung. (22. Januar 2017). Arten von Batterien: Komplette Führung mit Batterien und Batterien, die existieren. Abgerufen von: eccological.com
- « Tomás Mejía Biographie, Militärkarriere, Schießen
- Säuresäureanhydride, wie gebildet werden, Anwendungen und Beispiele »

