Tyrosineigenschaften, Struktur, Funktionen, Vorteile
- 2701
- 427
- Timo Rabenstein
Der Tyrosin (Tyr, y) ist eine der 22 Aminosäuren, aus denen die Proteine aller in Lebewesen vorhandenen Zellen bestehen. Im Gegensatz zu anderen Aminosäuren wie Valin, Treonin, Tryptophan, Leucin, Lysin und anderen ist Tyrosin eine "bedingt" im Wesentlichen essentielle Aminosäure.
Der Name "Tyrosin" stammt aus dem griechischen Wort "Schießen", Was Käse bedeutet, weil diese Aminosäure zuerst in diesem Essen entdeckt wurde. Der Begriff wurde 1846 von Liebig geprägt, der Käse mit Kaliumhydroxid mischte und eine unbekannte Verbindung erhielt, die kaum löslich in Wasser ist.
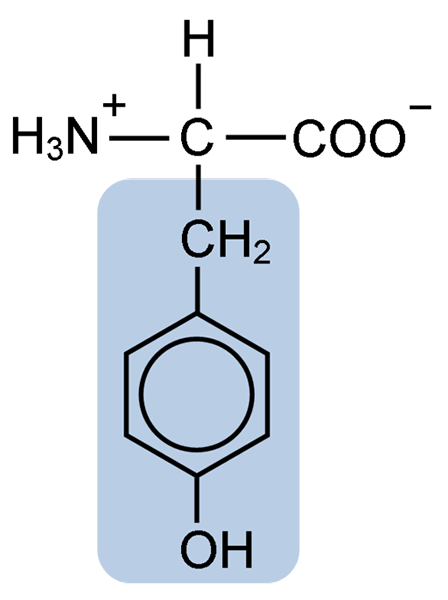
 Chemische Struktur der Tyrosinaminosäure (Quelle: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Chemische Struktur der Tyrosinaminosäure (Quelle: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) Nach der ersten Beschreibung wurden andere Forscher wie Warren de la Rue und Hinterberger aus Cocoid -Insekten bzw. Hörnerproteinen erhalten. Seine Trennung von der Hydrolyse anderer Proteine mit Salzsäure wurde 1901 von Mörner beschrieben.
Im Allgemeinen wird diese Aminosäure bei Säugetieren dank der Hydroxylierung von Phenylalanin erhalten, obwohl sie auch im Darm von den mit Lebensmitteln konsumierten Proteinen absorbiert wird.
Tyrosin hat mehrere Funktionen im menschlichen Körper und unter diesen sind die am relevantesten vielleicht das von Substrat für die Produktion von Neurotransmitter und Hormonen wie Adrenalin und Schilddrüsenhormon.
[TOC]
Eigenschaften
Tyrosin wiegt ungefähr 180 g/mol und seine R- oder Seitenkettengruppe hat eine 10 -Dissoziationskonstante 10.07. Die relative Häufigkeit in Zellproteinen überschreitet 4%nicht, hat aber mehrere wesentliche Funktionen für die menschliche Physiologie.
Diese Aminosäure gehört zur Gruppe aromatischer Aminosäuren, in denen Phenylalanin und Tryptophan auch sind. Die Mitglieder dieser Gruppe haben aromatische Ringe in ihren R R- oder Seitenketten und sind normalerweise hydrophobe oder apolare Aminosäuren.
Wie Tryptophan absorbiert Tyrosin ultraviolettes Licht und ist einer der Aminosäureabfälle, die für die Absorption von Licht bis 280 nm vieler Proteine verantwortlich sind, daher ist es für seine Charakterisierung nützlich.
Es wird als wesentliche "bedingt" Aminosäure angesehen, da seine Biosynthese beim Menschen von Phenylalanin abhängt, einer essentiellen Aminosäure. Wenn der Körper seine täglichen Anforderungen an Phenylalanin erfüllt, kann Tyrosin ohne Probleme synthetisiert werden und ist keine einschränkende Aminosäure.
Wenn die Ernährung jedoch an Phenylalanin fehlt, hat der Körper nicht nur ein Ungleichgewicht dieser Aminosäure, sondern auch von Tyrosin. Es ist auch wichtig darauf hinzuweisen, dass die Reaktion der Tyrosinsynthese aus Phenylalanin nicht reversibel ist, sodass das Tyrosin nicht den zellulären Bedürfnissen von Phenylalanin erfüllen kann.
Tyrosin gehört auch zur Aminosäuregruppe mit doppelten Funktionen bei der Produktion von glukogenen und ketogenen metabolischen Vermittlern, die an der Synthese von Glukose für das Gehirn und an der Bildung von Ketonkörpern in der Leber beteiligt sind.
Struktur
Wie der Rest der Aminosäuren, des Tyrosins oder der β-Parahydroxyphenyl-α-Amino-Propionsäure ist es eine α-Aminosäure mit einem zentralen Kohlenstoffatom, dem Carbon α bezeichnet und chiral ist, weil es verbunden ist, weil es verbunden ist, weil es verbunden ist, weil es verbunden ist, weil es verbunden ist vier verschiedene Substituentenatome oder Moleküle.
Dieser quirale Kohlenstoff ist mit zwei charakteristischen Gruppen von Aminosäuren verbunden: einer Amino -Gruppe (NH2) und einer Carboxylgruppe (COOH). Er teilt auch eine seiner Bindungen mit einem Wasserstoffatom und die verbleibende Bindung wird von der R- oder Seitenkette jeder Aminosäure besetzt.
Im Fall von Tyrosin besteht diese Gruppe aus einem aromatischen Ring, der mit einer Hydroxyl (OH) -Gruppe assoziiert ist, die ihm die Fähigkeit gibt, Wasserstoffbrücken mit anderen Molekülen zu bilden und ihm wesentliche funktionelle Eigenschaften für bestimmte Enzyme zu verleihen.
Es kann Ihnen dienen: BarorezeptorenFunktionen
Tyrosin ist ein grundlegender Bestandteil vieler Proteine mit großer Vielfalt an biologischen Aktivitäten und Funktionen.
Bei Menschen und anderen Säugetieren wird diese Aminosäure im Nerven- und Nierengewebe für die Synthese von Dopamin, Adrenalin und Norepinephrin genutzt.
Es ist auch für die Synthese von ultravioletten Strahlungsschutz (UV) wie Melanin essentiell; von einigen Analgetika wie Endorphinen und antioxidativen Molekülen wie Vitamin e.
In ähnlicher Weise dient diese Aminosäure für die Synthese von Tiramin-, Oktopamin- und Schilddrüsenhormonen durch Jodorganisation im Tyrosinrest des Thyoglobulins.
Tiramin ist ein vasoaktives Molekül, das im menschlichen Körper vorkommt, und Octopamin ist ein Amin im Zusammenhang mit Noreprrenalin.
Alle diese Funktionen von Tyrosin sind dank ihrer Erlangung aus den Proteinen der Ernährung oder durch Hydroxylierung von Phenylalanin mit der Leber als Hauptsystem der systemischen Versorgung der Aminosäure möglich.
Funktionen in Pflanzen
Tyrosin und einige der Vermittler, die während ihrer Biosynthese erzeugt wurden.
Biosynthese
Im Menschen wird Tyrosin aus der Ernährung erhalten oder in einem einzigen Schritt von Leberzellen aus Phenylalanin, einer essentiellen Aminosäure, durch das durch das Phenylalaninhydroxylase enzymatische Komplex katalysierte Reaktion erhalten.
Dieser Komplex hat eine Oxygenase -Aktivität und ist nur in der Leber von Menschen oder anderen Säugetieren vorhanden. Die Tyrosin -Synthese -Reaktion impliziert dann die Übertragung eines Sauerstoffatoms in die Position für des aromatischen Ringes von Phenylalanin.
Diese Reaktion tritt gleichzeitig auf, als ein Wassermolekül aufgrund der Verringerung eines weiteren molekulares Sauerstoffatom.
Biosynthese in Pflanzen
In Pflanzen wird Tyrosin synthetisiert von novo stromabwärts der „Shikimato“ -Route, die andere biosynthetische Wege anderer aromatischer Aminosäuren wie Phenylalanin und Tryptophan füttert.
In diesen Organismen basiert die Synthese auf einer Verbindung, die als "Corismato" bekannt ist, die das Endprodukt der Shikimato -Route und zusätzlich den gemeinsamen Vorläufer für alle aromatischen Aminosäuren, bestimmte Vitamine und Pflanzenhormone ist.
Der Corismat wird durch die katalytische Wirkung des Mutasa -Corismat -Enzyms in ein Vorwort umgewandelt, und dies ist der erste "begangene" Schritt in der Synthese von Tyrosin und Phenylalanin in Pflanzen.
Das Preddeneate wird durch eine oxidative Decarboxylierung und eine Transaminierung in Tyrosin umgewandelt, die in beliebiger Reihenfolge auftreten kann.
In einer der Biosynthesewege können diese Schritte durch spezifische Enzyme katalysiert werden, die als prädenatspezifische Dehydrogenase (PDH) bekannt sind (die das Vorwort in 4-Hydroxyphenylpyphenylpyruvat (HPP) und Tyrosin-Aminotransferase (die die Tyroinat (HPP) (HPP) (HPP) (die die Tyrosinat aus dem HPP) umwandelt, katalysiert werden. bzw.
Ein weiterer Weg der Synthese von Tyrosin aus dem Vorwort impliziert die Transaminierung des Preddeneate zu einer nicht proteinogenen Aminosäure, die als L-Arogenat bezeichnet wird, die durch die Enzympreenat-Aminotransferase katalysiert wurde.
Das L-Arogenat unterliegt anschließend einer oxidativen Decarboxylierung, um Thyroxin zu bilden, eine Reaktion, die durch ein Enzym-Tyrosin-arogenat-spezifischer Dehydrogenase, auch als ADH bekannt.
Pflanzen verwenden bevorzugt den Weg des Arenat.
Verordnung
Wie für die meisten Biosynthesewege von Aminosäuren sind Pflanzen ein striktes Regulierungssystem der Synthese von aromatischen Aminosäuren, einschließlich Tyrosin.
Kann dir dienen: Köstliches Monster: Eigenschaften, Lebensraum, Pflege, EigenschaftenIn diesen Organismen erfolgt die Regulierung auf vielen Ebenen, da die Mechanismen, die die Shikimato -Route kontrollieren.
Tyrosinanforderungen und damit die Steifheit bei der Regulierung ihrer Biosynthese sind für jede Pflanzenart spezifisch.
Degradierung
Der Abbau oder der Katabolismus von Tyrosin führt zur Bildung von Fumarat und Acetoacetat. Der erste Schritt dieser Route besteht in der Umwandlung der Aminosäure in 4-Hydroxyphenylpypypypen durch ein zytosolisches Enzym, das als Aminotransferase-Tyrosin bekannt ist.
Diese Aminosäure kann auch in den Mitochondrien von Hepatozyten durch ein Aminotransferase -Aspartatenzym transaminiert werden, obwohl dieses Enzym unter normalen physiologischen Bedingungen nicht sehr wichtig ist.
Durch den Abbau von Tyrosin kann Succinyl-Acetoacetat auftreten, was zu Succinylacetat decarboxyliert werden kann. Succinyl-Acetat ist der mächtigste Enzyminhibitor, der für die Synthese der Hämogruppe, der 5-Aminolevulin-Säure-Säure-Dehydratase, verantwortlich ist.
Adrenalin- und Noradrenalin -Synthese
Wie bereits erwähnt, ist Tyrosin eine der Hauptsubstrate für die Synthese von zwei sehr wichtigen Neurotransmitter für den menschlichen Körper: Adrenalin und Noradrenalin.
Dies wird zunächst von einem Enzym verwendet.
Der Dopa führt zu Dopamin, sobald es von einem Enzym Dopa decboxilas enzymatisch verarbeitet wird.
Dopamin wird anschließend durch die Wirkung des β -Oxidase -Dopamin -Enzyms in Norprrenalin umgewandelt, das die Zugabe einer Hydroxylgruppe zu -ch, die Teil der Gruppe R des Tyrosins war und die als "Brücke" zwischen dem aromatischen Ring war und Kohlenstoff α.
Adrenalin stammt aus Noradrenalin durch die Wirkung von Phenythanolamin N-Methyltransferase, die für die S-Adenosyl-Metionin-abhängige Übertragung einer Methylgruppe (-ch3) auf die freie Amino-Gruppe von Noradrenalin verantwortlich ist.
Lebensmittel, die reich an Tyrosin sind
Wie oben erwähnt, ist Tyrosin eine wesentliche "bedingt" Aminosäure, da es im menschlichen Körper durch Hydroxylierung von Phenylalanin, einer essentiellen Aminosäure, synthetisiert wird.
Wenn die Aufnahme von Phenylalanin den Körperanforderungen abdeckt. Tyrosin wird jedoch auch von Proteinen erworben, die mit täglichen Lebensmitteln konsumiert werden.
Einige Studien berichten, dass die minimale tägliche Aufnahme von Tyrosin und Phenylalanin zwischen 25 und 30 mg pro Kilogramm Gewicht liegen sollte, sodass eine durchschnittliche Person mehr oder weniger 875 mg Tyrosin pro Tag konsumieren sollte.
Lebensmittel mit höherem Tyrosingehalt sind Käse und Sojabohnen. Darunter befinden sich auch Rindfleisch, Lamm, Schweinefleisch, Hühnchen und Fisch.
Einige Samen und Nüsse wie Nüsse bieten auch signifikante Beiträge dieser Aminosäure sowie Eier, Milchprodukte, Getreide und Getreide.
Vorteile Ihrer Aufnahme
Tyrosin wird üblicherweise in Form von Nahrungsergänzungsmitteln oder Nahrungsergänzungsmitteln, insbesondere zur Behandlung der als Phenylcetonurie bekannten Pathologie, konsumiert, die von Patienten gelitten wurde, die Phenylalanin nicht richtig verarbeiten können, und daher keine Tyrosin produzieren.
Es kann Ihnen dienen: BeziehungsfunktionEs wird angenommen, dass eine Zunahme der pro Tag konsumierten Tyrosin die kognitiven Funktionen im Zusammenhang mit Lern-, Gedächtnis- und Alarmzustand unter stressigen Bedingungen verbessern kann.
Einige Leute nehmen Tirosin -reichen Tafeln, um tagsüber wach zu bleiben, wenn sie eine beträchtliche Anzahl von Schlafstunden verloren haben.
Da diese Aminosäure an der Bildung von Schilddrüsenhormon beteiligt ist, kann ihr Verbrauch positive Auswirkungen auf die systemische Stoffwechselregulation haben.
Mangelerkrankungen
Albinismus und Alkaptonurie sind zwei Pathologien im Zusammenhang mit dem Tyrosin -Metabolismus. Die erste Erkrankung hängt mit der defekten Melaninsynthese aus Tyrosin zusammen und die zweite hat mit Defekten bei der Abbau von Tyrosin zu tun.
Der Albinismus ist durch den Mangel an Pigmentierung in der Haut gekennzeichnet, dh die Patienten, die darunter leiden.
Diese Pathologie hat mit einem Mangel in der spezifischen Tyrosinase von Melanozyten zu tun, die für die Umwandlung von Tyrosin in Dopa-Quinon, einem Vermittler in der Synthese von Melanin, verantwortlich ist.
Die Symptome von Alkaptonurie sind als übertriebene Urinpigmentierung (dunkel) und späten Entwicklungsarthritis erkennbar.
Andere Stoffwechselpathologien
Darüber hinaus gibt es andere Störungen im Zusammenhang mit dem Tyrosin -Stoffwechsel, darunter:
- Erbliche Tyrosinämie vom Typ I: gekennzeichnet durch progressive Leberdegeneration und Nierenfunktionsstörung
- Erbliche Tyrosinämie vom Typ II oder Richner-Hanhart-Syndrom: Was als Keratitis und Ampularläsionen in den Handflächen der Hände und Füße ersichtlich ist
- Tyrosinämie vom Typ III: die asymptomatisch oder als mentale Verzögerungen vorhanden sein kann
- "Hawkinsinuria": gekennzeichnet durch metabolische Azidose in der Kindheit und der Unfähigkeit, im Wachstum zu gedeihen
Es gibt auch andere angeborene Defekte im Metabolismus des Metrosins, die mit Mängel in den für ihren Abbau verantwortlichen Enzymen wie Hydroxylase -Tyrosin zu tun haben, die für den ersten Schritt der Synthese von Dopamin aus Tyrosin verantwortlich sind.
Verweise
- Eder Plimmer, r. (1908). Die chemische Konstitution der Proteine. Ich ging weg. London, Großbritannien: Longmans, Green und Co.
- Chakrapani, a., Gissen, p., & McKiernan, p. (2012). Störungen des Tyrosin -Stoffwechsels. In Inborn metabolischer Verlangen: Diagnose und Behandlung (pp. 265-276).
- Kretchmer, n., Levine, s., McNamara, h., & Barnett, h. (1956). Bestimmte Aspekte des Tyrosin -Stoffwechsels in jungen Jahren. Yo. Die Entwicklung des Tyrosinoxidationssystems in der menschlichen Leber. Das Journal of Clinical Investigation, 35(10), 1089-1093.
- Du, b., Zannoni, v., Laster, l., & Seegmiller, e. (1958). Die Art des Defekts im Tyrosin -Stoffwechsel in Alkaptonurie. Zeitschrift für Biologische Chemie, 230, 251-260.
- Murray, r., Bender, d., Botham, k., Kennelly, p., Rodwell, v., & Weil, p. (2009). Harpers illustrierte Biochemie (28. ed.). McGraw-Hill Medical.
- Nelson, d. L., & Cox, m. M. (2009). Lehninger Prinzipien der Biochemie. Omega -Ausgaben (5. Aufl.).
- Schenck, c. ZU., & Maeda, h. ZU. (2018). Tyrosinbiosynthese, Stoffwechsel und Katabolismus in Pflanzen. Phytochemie, 149, 82-102.
- Slominski, a., Zmijewski, m. ZU., & Paweley, j. (2012). L-Tyrosin- und L-Dihydroxyphenylalanin als hormonähnliche Regulatoren der Melanozytenfunktionen. Pigmentzellen- und Melanomforschung, 25(1), 14-27.
- Van de, g. (2018). Gesundheitslinie. Abgerufen am 16. September 2019 von www abgerufen.Gesundheit.com
- MD Web. (N.D.). Abgerufen am 15. September 2019 von www abgerufen.Webmd.com
- Whitbread, d. (2019). Meine Lebensmitteldaten. Abgerufen am 15. September 2019 von www abgerufen.Myfooddata.com
- « Sozialhilfefunktionen, Typen, Einrichtungen in Mexiko
- Tachtenberg -Methode Was ist, Beispiele, Beispiele »

