Toluolstruktur, Eigenschaften, Verwendungen, erhalten
- 5066
- 199
- Tizian Liebich
Er Toluol Es ist ein aromatisches Kohlenwasserstoff, dessen kondensierte Formel c ist6H5CH3 oder Phch3 und das besteht aus einer Methylgruppe (CH3) zusammen mit einem Benzenen Ring oder einer Phenylgruppe (pH). Es ist natürlich in Rohöl, in Kohle, in vulkanischen Emanationen und in einigen Bäumen wie der Tolú de América im Süden zu finden.
Dieser charakteristische Geruchslösungsmittel wird hauptsächlich als industrielles Rohstoff und als Lackverdünnung verwendet. Es wird auch zur Beseitigung von Parasiten verwendet, die bei Katzen und Hunden wie Ascariden und Anylostomes vorhanden sind.
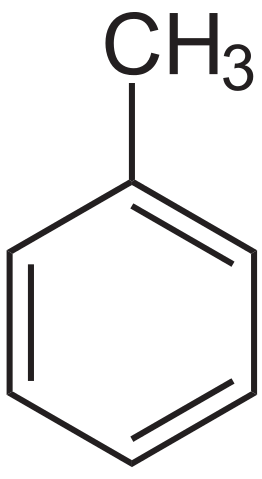
 Toluol -Strukturformel. Quelle: Neurotoger über Wikipedia.
Toluol -Strukturformel. Quelle: Neurotoger über Wikipedia. Das Toluol wurde zum ersten Mal von Pierre-Joseph Pelletier und Philippe Walter 1837 von Kiefernöl isoliert. Anschließend isolierte Henri Etienne Sainte-Claire Deville 1841 aus dem Tolú Balm und wies darauf hin, dass sein Produkt dem zuvor isolierten ähnlich war. 1843 taufte ihn Berzelius als Toluin taufe.
Der größte Teil von Toluol wird als laterales oder sekundäres Produkt in Gasproduktionsprozessen und Kohleumwandlung in Koks erhalten. Es wird auch durch Reaktionen im Labor erzeugt, zum Beispiel die Benzolreaktion mit dem Methylchlorid.
[TOC]
Struktur
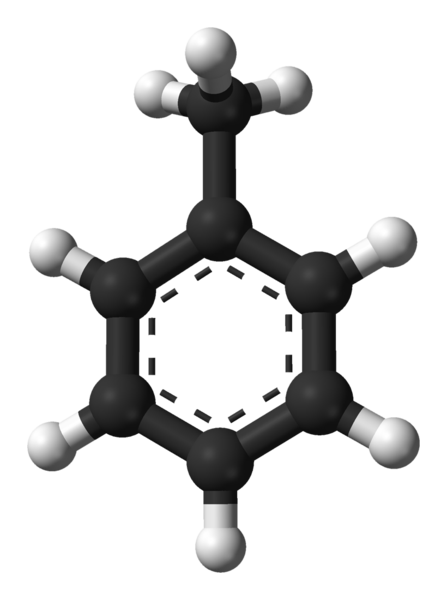 Molekülstruktur von Toluol. Quelle: Ben Mills über Wikipedia.
Molekülstruktur von Toluol. Quelle: Ben Mills über Wikipedia. Im überlegenen Bild haben wir die molekulare Struktur des Toluols durch ein Modell von Kugeln und Balken. Beachten Sie, dass es genauso aussieht wie die angegebene Strukturformel, mit dem Unterschied, dass es sich nicht vollständig um ein flaches Molekül handelt.
In der Mitte des Benzolrings, der in diesem Fall als Phenylgruppe, pH, angesehen werden kann, wird sein aromatischer Charakter durch die gepunkteten Linien hervorgehoben. Alle Kohlenstoffatome haben SP -Hybridisierung2, Außer der Cho -Gruppe3, deren Hybridisierung spt ist3.
Aus diesem Grund ist das Molekül nicht vollständig flach: Cho -Hydrogene3 Sie befinden sich in verschiedenen Winkeln der Benzenischen Ringebene.
Kann Ihnen dienen: IonisationskonstanteToluol ist ein apolares, hydrophobe und aromatisches Molekül. Seine intermolekularen Wechselwirkungen basieren auf den dispersiven Kräften von London und in Dipolo-Dipolo-Wechselwirkungen, da das Zentrum des Rings der von der CH bereitgestellten elektronischen Dichte „belastet“ ist3; Während Wasserstoffatome eine geringe elektronische Dichte aufweisen.
Daher hat Toluol verschiedene Arten von intermolekularen Wechselwirkungen, die die Moleküle ihrer flüssigen kohäsiv halten. Dies spiegelt sich in seinem Siedepunkt 111 ° C wider, was stark ist, wenn man bedenkt, dass es sich um ein apolares Lösungsmittel handelt.
Eigenschaften
Aussehen
Farblose und transparente Flüssigkeit
Molmasse
92,141 g/mol
Geruch
Süß, Morgen und ähnlich wie Benzol
Dichte
0,87 g/ml bei 20 ºC
Schmelzpunkt
-95 ºC
Siedepunkt
111 ºC
Löslichkeit
Toluol hat eine verabscheuungswürdige Löslichkeit im Wasser: 0,52 g/l bei 20 ° C. Dies ist auf den Unterschied in den Polaritäten zwischen Toluol und Wasser zurückzuführen.
Andererseits ist Toluol löslich oder in diesem Fall mischbar mit Ethanol, Benzol, Ethylether, Aceton, Chloroform, Gletscher Essigsäure und Kohlenstoffdisulfid; Das heißt, es ist besser solubilisiert in weniger polaren Lösungsmitteln.
Brechungsindex (nD)
1.497
Schmiere
0,590 CP (20 ºC)
Zündungspunkt
6 ºC. Toluol muss in Gas extrahierenden Lagern und so weit wie möglich von jeder Flamme entfernt werden.
Wasserdampfdichte
3.14 in der Luftbeziehung = 1. Das heißt, ihre Dämpfe sind dreimal dichter als die Luft.
Dampfdruck
2.8 kPa bei 20 ° C (ca. ca. 0.27 atm).
Self -Anmut -Temperatur
480 ° C
Zersetzung
Kann kräftig mit oxidierenden Materialien reagieren. Wenn er zur Zersetzung erhitzt wird.
Oberflächenspannung
29,46 mn bei 10 ° C
Dipolarem Moment
0,36 d
Reaktivität
Toluol ist anfällig für Chlorierung, um Ortho-Chlorotoluol und Para-Clorotoluol zu produzieren. Es ist auch leicht zu nitrifizieren, Nitrotoluol zu produzieren, dem Rohmaterial der Farbstoffe.
Kann Ihnen dienen: AtomgewichtEin Teil von Toluol wird mit drei Teilen Salpetersäure kombiniert, um Trinitrotoluol (TNT) zu verursachen: einer der bekanntesten Sprengstoff.
Ebenso erfährt Toluol Sulfonation, um O-Toluen-Sulfonik- und P-Toluen-Sulfonsäuren zu erzeugen, die das Rohstoff für die Herstellung von Farbstoffen und Saccharin sind.
Die Toluol -Methylgruppe erfährt aufgrund der Wirkung einer starken Basis einen Wasserstoffverlust. Die Methylgruppe ist auch anfällig für Oxidation, so dass sie mit Kaliumpermanganat reagiert, um Benzoikum und Benzaldehydsäure zu verursachen.
Anwendungen
Industrielle
 Der TNT, der symbolischste Sprengstoff von allen, tritt durch das Toluol als Haupt Rohstoff auf. Quelle: Pixabay.
Der TNT, der symbolischste Sprengstoff von allen, tritt durch das Toluol als Haupt Rohstoff auf. Quelle: Pixabay. Toluol wird zur Ausarbeitung von Gemälden, Verdünnungen von Farben, Nagelpoliert, Klebstoffen oder Zahnfleisch aus Paste, Lack, Tinten, Nylon, Kunststoff, Polyurethanschaum, meisten Ölen, Vinylorganen, Arzneimitteln, Farbstoffen, Parfüms, Sprengstoffen (TNT) verwendet.
Ebenso wird Toluol in Form von Toluenosulfonados bei der Herstellung von Waschmittel verwendet. Toluol ist auch von großer Bedeutung für die Herstellung von Plastikzementen, kosmetischen Färbempfahl, Frostschutzmittel, Tinten, Asphalt, permanente Marker, Kontaktzemente usw.
Lösungsmittel und Verdünnungsmittel
Toluol wird in der Verdünnung der Gemälde verwendet, was seine Anwendung erleichtert. Es wird verwendet, um die Kanten der Polystyrol -Kits aufzulösen, sodass die Vereinigung der Teile, die Modelle von Skalenflugzeugen bilden. Darüber hinaus wird es bei der Extraktion von Naturprodukten aus Pflanzen verwendet.
Toluol ist ein Tintenlösungsmittel, das im gravierten Loch verwendet wird. Mit Gummi und Toluol gemischte Zemente werden verwendet, um eine große Anzahl von Produkten abzudecken. Ebenso wird Toluol als Lösungsmittel in Print -Tinten, Lackern, Ledergeräuschen, Kleber und Desinfektionsmitteln verwendet.
Kann Ihnen dienen: molar absorbierendUnd noch interessanter, Toluol wird als Lösungsmittel für Kohlenstoffnanomaterialien (wie Nanoröhren) und Fullerens verwendet.
Andere
Ein Gemisch aus Benzol, Toluol und Xylol (BTX) wird zu Benzin gegeben, um seine Oktan zu erhöhen. Toluol ist ein Additiv aus Flugzeuggas und hoher Oktanzreserve. Es wird auch bei der Ausarbeitung von NAFTA verwendet.
Toluol hilft bei der Beseitigung einiger Arten von Ascáriden und Anquilostomos sowie zehnias, die Parasiten von Katzen und Hunden sind.
Erhalten
Der größte Teil des Toluols wird aus destillierten Produkten aus Rohöl erhalten, die während der Kohlenwasserstoffpyrolyse (Dampfknacken) erzeugt werden, erzeugt werden. Die katalytische Reform von Öldämpfern entspricht 87 % des produzierten Toluols.
Zusätzliche 9 % Toluol aus Pyrolyse -Benzin, die während der Herstellung von Ethylen und Propylen hergestellt wurden.
Hulla -Teer von Koksöfen trägt 1 % zum produzierten Toluol bei, während die verbleibenden 2 % als Nebenprodukt der Herstellung der Dehnung erhalten werden.
Schädliche Effekte
Toluol ist ein Lösungsmittel, das in eingehalte Hochstoffe inhaliert wird, da es eine Betäubungsmittelwirkung hat, die die Funktionsweise des Zentralnervensystems beeinflusst. Toluol tritt zur Aufnahme, Inhalation und Absorption durch die Haut in den Körper ein.
Bei einem Maß an Exposition von 200 ppm, Anregung, Euphorie, Halluzinationen, verzerrten Wahrnehmungen, Kopfschmerzen und Schwindel auftreten. Während ein höheres Maß an Toluol -Exposition Depressionen, Schläfrigkeit und Stupor erzeugen kann.
Wenn die Inhalation eine Konzentration von 10 überschreitet.000 ppm ist in der Lage, den Tod des Individuums aufgrund von Atemversagen zu erzeugen.
Verweise
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. (10th Auflage.). Wiley Plus.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Morrison und Boyd. (1987). Organische Chemie. (Fünfte Ausgabe). Addison-Wesley Iberoamericana.
- Nationales Zentrum für Biotechnologie Information. (2020). Toluol. Pubchem -Datenbank., CID = 1140. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Wikipedia. (2020). Toluol. Abgerufen von: in.Wikipedia.Org
- Engineering Toolbox, (2018). Toluol - Thermophysikalische Eigenschaften. [Online] geborgen von: EngineeringToolbox.com
- Vedantu. (S.F.). Toluol. Erholt von: Vedantu.com
- « Zerstörerische Interferenzformel und Gleichungen, Beispiele, Übung
- Polyvinylpirrolidonstruktur, Eigenschaften, Verwendungen, Nebenwirkungen »

