Kohlenstoffatom
- 3805
- 1151
- Nick Laurén
Wir erklären, was das Kohlenstoffatom, seine elektronische Struktur, seine Eigenschaften und die Orbitalhybridisierung ist.
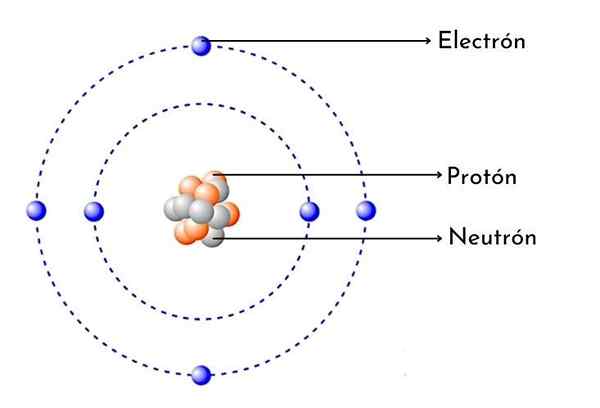
 Kohlenstoffatomschema
Kohlenstoffatomschema Was ist Kohlenstoffatom?
Kohlenstoff ist Elementnummer 6 der Periodenzüchter und eines der wichtigsten Elemente, die existieren. Seine Bedeutung ergibt Basis des Lebens auf dem Planeten Erde, wie wir wissen.
Es geht um einen Nicht-Metal zugehörig Gruppe 14 der Periodenzüchtertabelle (ehemals Gruppe 4a) und die zweite Periode. In seiner natürlichen Form ist es mit Kohle (sowohl Mineral- als auch Gemüse) und den Ruß verbunden, in dem es sich hauptsächlich in Form von Graphit oder anderen Alotrope befindet.
Er Kohlenstoffatom Es gehört zu den kleinsten der Periodenzüchter. Es ist ein tetravalentes Atom, das heißt, es kann sich bilden bis zu vier Links mit anderen Atomen, die gleich oder unterscheiden sich von denselben.
Kohlenstoff ist für den Menschen von großer Bedeutung. Es ist eine der Hauptkomponenten unseres Körpers und bildet mehr als 19% seiner Masse. Darüber hinaus enthält es mehrere technologische Anwendungen, die aus seinen Atomeigenschaften abgeleitet wurden.
Eigenschaften des Kohlenstoffatoms
- Das Kohlenstoffatom ist ein Nicht -Metall: Carbon ist ein nicht -metallisches Element, das mit vielen anderen Elementen der Periodenzüchter kombiniert werden kann. Kohlenstoffatome können anderen Atomen Elektronen erwerben oder geben, wodurch Anionen oder Kationen werden.
- Es hat 6 Protonen im Kern: Die Atomzahl von Kohlenstoff beträgt 6, was bedeutet, dass er 6 Protonen im Kern hat. Es bedeutet auch, dass ein neutrales Kohlenstoffatom 6 Elektronen um den Kern hat.
Kann Ihnen dienen: Magnetische Trennung- Es gehört zum Block P des Periodensystems: Die elektronische Kohlenstoffkonfiguration in ihrem grundlegenden Zustand beträgt 1s2 2s2 2 p2. Wie zu sehen ist, befinden sich die letzten Valencia -Elektronen in P -Orbitalen, so.
- Die Valenzen des Kohlenstoffatoms betragen +2, +4 und -4: In der Kohlenstoffvalenzschicht fehlt nur 4 Elektronen, um sie vollständig zu füllen und somit die elektronische Konfiguration von edlem Neongas zu erwerben. Aus diesem Grund kann Kohlenstoff den Carbid -Anion bilden, C4-, das hat 4 Elektronen mehr als neutraler Kohlenstoff. Andererseits kann das Kohlenstoffatom auch die beiden 2p -Elektronen verlieren und somit zum Kohlenstoffkation werden (C2+) oder alle 4 Elektronen in Valencia, die zum Kohlenhydrat -Kation werden (C4+).
- Sie können mehrere Alotrope bilden: Elementarer Kohlenstoff kann in zwei gemeinsamen natürlichen Formen gefunden werden, die Graphit und Diamant sind, die radikal entgegengesetzte Eigenschaften aufweisen. Außerdem können Sie verschiedene Jungs, Carbon- und Graphen -Nanoröhren bilden.
Die drei Isotope des Kohlenstoffatoms
Alle Kohlenstoffatome haben sechs Protonen in ihrem Kern, aber nicht alle die gleiche Anzahl von Neutronen, was zu drei Isotopen führt:
- Carbon-12 (12C): Es ist das stabilste und reichlichste (ungefähr 98,9%). Es hat 6 Neutronen in seinem Kern.
- Carbon-13 (13C): Es hat 7 Neutronen.
- Carbon-14 (14C): Es ist radioaktive YS E verwendet für die Daten alter Objekte.
Elektronische Struktur des Kohlenstoffatoms
Wie jedes Kohlenstoffatom hat es sechs positive Protonen im Kern, dann hat es auch 6 Elektronen wobei sich die negative Belastung umdreht.
Kann Ihnen dienen: Aliquot (Chemie)Die Art und Weise, wie diese Elektronen verteilt sind oder die elektronische Konfiguration des Kohlenstoffatoms ist:
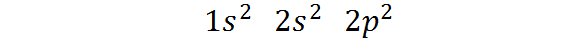
Diese elektronische Konfiguration zeigt das an Carbon hat 2 Elektronen im 1S -Orbital, Zwei Elektronen in Orbital 2s, Und Zwei Elektronen, die unter den drei Orbitalen 2p verteilt sind.
Andererseits ist die Valenzschicht für Kohlenstoff die Schicht L, die dem Level N = 2 entspricht, da es sich um die höchste Ebene enthält, die Elektronen enthält. Wie wir sehen können, hat Carbon insgesamt 4 Elektronen auf Stufe 2, Also sagen wir das Es hat 4 Valencia -Elektronen.
Dies ist der Grund, warum sich der Kohlenstoff zuvor befindet, in dem er zuvor Gruppe 4A des Periodensystems bezeichnet wurde.
Atom -Orbitalhybridisierung im Kohlenstoffatom
Atome reagieren und verbinden sich durch ihre Valenzelektronen und die Orbitale, die sie besetzen. Letztere haben jedoch nicht immer eine ausreichende Ausrichtung, um die erforderlichen Verbindungen zu bilden.
Die Link -Theorie von Valencia besagt, dass Atome ihre Atomorbitale mischen, um neue Hybridorbitale zu bilden, die eine ordnungsgemäße Anleitung haben. Dieser Prozess wird genannt Hybridisierung.
Abhängig von der Anzahl der Atome, mit denen ein Kohlenstoffatom miteinander verbunden ist, mischt es eine andere Anzahl reiner Atomorbitale. Dies führt zu drei verschiedene Hybridisierungen, Was sind Sie:
Sp
Tritt auf, wenn Kohlenstoff nur mit verbunden ist Zwei Atome. In diesem Fall werden das Orbital S mit einem der drei P -Orbitale gemischt, was zu zwei SP -Orbitalen führt, die in entgegengesetzte Richtungen (180º voneinander) zeigen,.
Kann Ihnen dienen: QuecksilberbarometerDie beiden P -Orbitale, die ohne Mischung übrig bleiben. Kohlenstoffatom kann sich bilden Ein dreifacher Link (die zwei PI -Bindungen enthält) mit einem einzelnen Atom oder können sich bilden können Zwei Doppelverbindungen, eins mit jedem Atom (und mit einem Link PI jeweils).
Sp2
Wenn Carbon beitreten will Drei Atome, Sie benötigen drei hybride Orbitale, also mischen Sie drei reine Orbitale: das Orbital S und zwei Orbitale p. Dies erzeugt drei SP -Hybridorbitale2 Dies deuten auf die Ecken eines gleichseitigen Dreiecks hin.
Das Orbital P, das nicht verwendet wurde.
Sp3
Wenn Kohlenstoff mit einer Verbindung zu Verknüpfung Vier Atome, Mischen Sie die 4 reinen Orbitale Ihrer Valenzschicht, um 4 hybride Orbital -SP zu erzeugen3. Diese zeigen auf die Eckpunkte eines normalen Tetraeders.
Da es keine Orbitale gibt, um PI -Bindungen zu bilden, ein Kohlenstoff mit SP -Hybridisierung3 Sie können nur vier einfache Links und keinen mehrfachen Link bilden.
Verweise
- Britannica, die Herausgeber von Encyclopaedia. Kohlenstoff - Fakten, Verwendungen und Eigenschaften. Stammen aus https: // www.Britannica.com/science/carbon-chemische Elemente
- Globales Überwachungslabor. (S. F.). Treibhausgase mit Kohlenstoffzyklus. Stammen aus https: // gml.NOAA.GOV/CCG/ISOTOPES/Chemie.Html

