Topoisomerase Was sind, Eigenschaften, Funktionen, Typen
- 5075
- 968
- Lewis Holzner
Der Topoisomerase Sie handelt.
Diese Enzyme spielen eine spezifische Rolle bei der Linderung der Torsionspannung in der DNA, so dass solche wichtigen Prozesse, die Transkription der DNA in der Messenger -Ribonukleinsäure (RNAM) und die Rekombination der DNA auftreten können.
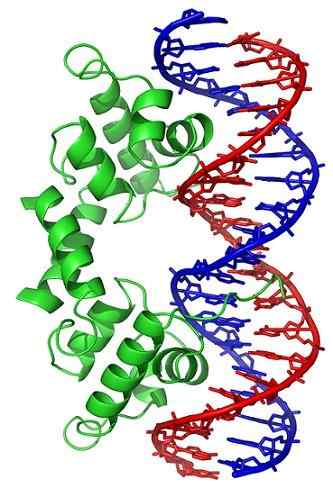
 Topoisomerase II, Wikimedia Commons
Topoisomerase II, Wikimedia Commons Topoisomerase -Enzyme sind sowohl in eukaryotischen als auch in prokaryotischen Zellen vorhanden. Seine Existenz wurde von Wissenschaftlern Watson und Crick vorhergesagt, als die Einschränkungen der DNA -Struktur bewertet wurden, um den Zugriff auf ihre Informationen zu ermöglichen (in ihrer Nucleotid -Sequenz gespeichert).
Um die Funktionen der Topoisomerase zu verstehen, sollte berücksichtigt werden.
Diese linearen Ketten bestehen aus 2-Dechexiribosas, die mit 5'-3 'Phosphodi-Fo. verbunden sind.
Die topologische Untersuchung von DNA.
DNA -Moleküle mit unterschiedlichen Konformationen werden als Topoisomere bezeichnet. Daher können wir zu dem Schluss kommen, dass Topoisomerasen I und II die Spannung der Torsion von DNA.
Unter den möglichen DNA -Topoisomeren ist die häufigste Konformation die von Superstrane, die sehr kompakt ist. Der DNA -Doppelpropeller muss jedoch auch durch Topoisomerasen während mehrerer molekularer Prozesse unbegründet sein.
Eigenschaften
Mechanismus der allgemeinen Wirkung
Einige Topoisomerasen können nur negatives Überschreiben der DNA oder beides Überstufe der DNA entspannen: positiv und negativ.
Wenn sich die kreisförmige dynamische DNA auf der Längsachse und einer Levogira -Rückkehr (in Richtung der Taktnadeln) entspannt, wird gesagt, dass sie negativ überlappend ist. Wenn die Rückkehr dextrogyral ist (im Gegensatz zu den Taktnadeln), ist sie positiv überwältigt.
 DNA -Kreiskreislautsprecher negativ, entspannt und positiv überwältigt. Quelle: Fdardel [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] aus Wikimedia Commons
DNA -Kreiskreislautsprecher negativ, entspannt und positiv überwältigt. Quelle: Fdardel [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] aus Wikimedia Commons Grundsätzlich können Topoisomerasen:
-Erleichtern Sie den Durchgang eines DNA -Strangs durch einen Schnitt im gegenüberliegenden Strang (Topoisomerase Typ I).
-Erleichtern Sie den Durchgang eines vollständigen Doppelpropellers durch einen Split in sich oder durch eine Aufteilung in einem anderen Doppelpropeller (Topoisomerase Typ II).
Zusammenfassend lässt sich sagen. Dann modifizieren sie den Rollzustand der Stränge eines Doppelpropellers (Molemomerase topoisomerase) oder zwei Doppelpropeller (Molemomerase II), um endlich erneut zu binden oder die geteilten Enden zu binden.
Topoisomerase und Zellzyklus
Obwohl die Topoisomerase I ein Enzym ist, das die größte Aktivität während der Phase S (DNA.
Kann Ihnen dienen: Saponifierbare Lipide: Eigenschaften, Struktur, Funktionen, BeispieleWährend die Topoisomerase -II -Aktivität während der logarithmischen Phase des Zellwachstums und der schnellen Wachstumszellen aktiver ist.
Funktionen
Die Veränderung der Gene, die codieren. Zu den Prozessen, an denen Topoisomerase teilnimmt, gehören:
Kompakte Speicherung von genetischem Material
Topoisomerasen erleichtern die Speicherung genetischer Informationen kompakt.
Zugang zu genetischen Informationen
Wenn es keine Topoisomerase und ihre einzigartigen Eigenschaften gibt, wäre der Zugriff auf in der DNA gespeicherte Informationen unmöglich. Dies liegt an der Tatsache, dass Topoisomerase die Spannung aufgrund von Torsion, die im Doppel -DNA -Propeller erzeugt wird.
Wenn die Spannung aufgrund von Torsion während dieser Prozesse nicht freigesetzt wird, kann eine defekte Genexpression auftreten, die Unterbrechung der kreisförmigen DNA oder des Chromosoms, der sogar den Zelltod erzeugt.
Regulation der Genexpression
Die Konformationsänderungen (in der dreidimensionalen Struktur) des DNA -Moleküls enthüllen spezifische Regionen, die mit DNA -Proteinen interagieren können. Diese Proteine haben eine regulatorische Funktion der genetischen Expression (positiv oder negativ).
 Genetisches Expression regulatorischer Protein. Wikimedia Commons
Genetisches Expression regulatorischer Protein. Wikimedia Commons Somit beeinflusst der Rollzustand der DNA, der durch die Wirkung von Topoisomerasen erzeugt wird.
Besonderheiten der Topoisomerase II
Topoisomerase II ist für den Zusammenbau von Chromatiden, Kondensation und Chromosomen und die Trennung von DNA -Töchtern während der Myitose während der Myitose erforderlich.
Dieses Enzym ist auch ein Strukturprotein und einer der Hauptbestandteile der Zellkernmatrix während der Grenzfläche.
Arten von Topoisomerase
Es gibt zwei Haupttypen von Topoisomerasen, je nachdem, ob sie ein oder zwei DNA -Ketten teilen können.
-Topoisomerase Typ i
Monomer
Topoisomerase Typ I sind Monomere, die ein negatives und positives Überschreiben lindern, die durch die Bewegung der Gabel während der Transkription und während der Replikations- und Genrekombinationsprozesse erzeugt werden.
Topoisomerasen vom Typ I können in Typ 1A und Typ 1B unterteilt werden. Letztere sind diejenigen, die beim Menschen enthalten sind, und sind für die Entspannung der Übersichts -DNA verantwortlich.
Tyrosin an seinem aktiven Ort
Topoisomerase 1B (TOP1B) besteht aus 765 Aminosäuren, die in 4 spezifische Domänen unterteilt sind. Einer dieser Domänen hat einen hoch erhaltenen Bereich, der das aktive Zentrum mit Tyrosin (Tyr7233) enthält. Alle Topoisomerase in ihrem aktiven Zentrum ein Tyrosin mit einer grundlegenden Rolle im gesamten katalytischen Prozess.
Wirkmechanismus
Das Tyrosin des aktiven Zentrums bildet eine kovalente Bindung zum 3'-phosphat-Ende der DNA.
Es kann Ihnen dienen: Flora und Fauna der Ecuadorian Sierra: Repräsentative ArtenDer Durchgang des anderen DNA -Strangs durch den geteilten Strang wird dank einer Konformationsumwandlung des Enzyms erreicht, die die Öffnung der Doppelhelix der DNA erzeugt.
Dann kehrt die Topoisomerase I zu seiner anfänglichen Konformation zurück und landet erneut die Enden aufgeteilt. Dies geschieht aufgrund eines inversen Verfahrens zum Bruch der DNA -Kette in der katalytischen Stelle des Enzyms. Schließlich setzt die Topoisomerase den DNA -Strang frei.
Die DNA -Ligationsrate ist größer als die Spaltrate, die die Stabilität des Moleküls und die Integrität des Genoms gewährleistet.
Zusammenfassend ist die Topoisomerase vom Typ I:
- Die Spaltung eines Strangs.
- Der Durchgang des anderen Strangs durch die Spaltung.
- Die Ligation der Enden spaltete sich.
-Typ II Topoisomerase
Dimmer
Topoisomerasen vom Typ II sind Dimérica -Enzyme, die gespalten werden.
Mg abhängig++ und ATP
Diese Enzyme benötigen Magnesium (mg++) Und sie brauchen auch die Energie, die aus dem Bruch der ATP -Triffosphat -Verbindung herrührt, die dank einer ATPase ausnutzt.
Zwei aktive Stellen mit Tyrosin
Menschliche Topoisomerasen sind denen von Hefe sehr ähnlich (Saccharomyces cerevisiae), die aus zwei Monomeren besteht (Subfragments A und B). Jedes Monomer präsentiert eine ATPASA -Domäne und in einer Subfragment die Tyrosin 782 der aktiven Stelle, zu der die DNA verbunden werden kann. Daher können zwei DNA -Stränge mit Topoisomerase II verbunden werden.
Wirkmechanismus
Der Wirkungsmechanismus der Topoisomerase II entspricht dem für Topoisomease I beschriebenen, wenn man bedenkt, dass zwei DNA -Ketten aufgeteilt sind und nicht nur einer.
In der aktiven Stelle der Topoisomerase II wird es stabilisiert (durch eine kovalente Vereinigung mit Tyrosin), ein Fragment von Doppelpropeller von DNA, "Fragment G" genannt. Dieses Fragment wird geteilt und durch kovalente Bindungen am aktiven Zentrum zusammengehalten.
Dann ermöglicht das Enzym ein anderes DNA -Fragment, das als "Fragment t" bezeichnet wird.
Die Topoisomerase II -Liga Die beiden Enden des "G -Fragments" und schließlich ihren Anfangszustand wiedererlangt, wodurch das Fragment "G" veröffentlicht wird. Dann entspannt die DNA die Torsionsspannung und ermöglicht Replikations- und Transkriptionsprozesse.
-Menschliche Topoisomerase
Das menschliche Genom hat fünf Topoisomerase: Top1, Top3α, Top3β (vom Typ I); und Top2α, Top2β (Typ II). Die relevantesten menschlichen Topoisomerasen sind TOP1 (Topoisomerase Typ IB) und 2α (Topoisomerase Typ II).
Topoisomerase -Inhibitoren
-Topoisomerase als chemisches Angriffsziel
Da die durch Topoisomerasen katalysierten Prozesse für das Überleben von Zellen erforderlich sind, sind diese Enzyme ein guter Angriff, der maligne Zellen beeinflusst. Daher werden Topoisomerase als wichtig bei der Behandlung vieler menschlicher Krankheiten angesehen.
Die Medikamente, die mit Topoisomerase interagieren.
Kann Ihnen dienen: Glykogen: Struktur, Synthese, Abbau, Funktionen-Arten der Hemmung
Die inhibitorischen Arzneimittel der Topoisomerase -Aktivität können:
- DNA -Interkalat.
- Beeinflussen das Topoisomerase -Enzym.
- Interkalieren in ein Molekül in der Nähe des aktiven Zentrums des Enzyms, während der DNA-Topoisomerase-Komplex stabilisiert ist.
Die Stabilisierung des vorübergehenden Komplexes, der durch die Vereinigung von DNA zum Tyrosin der katalytischen Stelle des Enzyms gebildet wird, verhindert die Vereinigung der geteilten Fragmente, die zum Zelltod führen können.
-Medikamente Topoisomerase -Inhibitoren
Unter den Verbindungen, die Topoisomerase hemmen, sind die folgenden.
Antitumorantibiotika
Antibiotika werden gegen Krebs eingesetzt, da sie das Wachstum von Tumorzellen verhindern, die normalerweise ihre DNA stören. Sie werden normalerweise als antineoplastische Antibiotika bezeichnet (gegen Krebs). Actinomycin D beeinflusst beispielsweise die Topoisomerase II und wird in Wilms -Tumoren bei Kindern und in Rabbomiosarkomen verwendet.
Anthracyclines
Anthracyclinen sind unter Antibiotika der wirksamsten Antikrebsmedikamente und breiteres Spektrum. Sie werden bei der Behandlung von Lungenkrebs, Eierstöcken, Gebärmutter, Magen, Blase, Brust, Leukämie und Lymphomen eingesetzt. Es ist bekannt, dass es die Topoisomerase II durch Interkalation in der DNA beeinflusst.
Der erste isolierte Anthracyclin einer Actinobakterien (Streptomyces peucetius) Es war das Daunorubicin. Anschließend wurde Doxorubicin im Labor synthetisiert, und es wird auch Epirubicin verwendet, und Idarubicin.
Antraquinone
Antraquinone oder Antrracenedas sind Verbindungen, die von Anthracen abgeleitet wurden, ähnlich wie Anthracyclines, die die Aktivität von Topoisomerase II durch Interkalation in der DNA beeinflussen. Sie werden für metastasierte Brustkrebs, nicht -hodgkinisches Lymphom (LNH) und Leukämie verwendet.
Diese Medikamente wurden in den Pigmenten einiger Insekten, Pflanzen (Frogula, Sen, Rhibarb), Flechten und Pilzen gefunden; sowie in La Hoelita, einem natürlichen Mineral. Abhängig von Ihrer Dosis können sie krebserregend sein.
Unter diesen Verbindungen haben wir Mythoxantrona und sein Analogon the losxantrona. Diese verhindern die Proliferation von malignen Tumorzellen und verbinden sich irreversibel DNA.
Epidophilotoxine
Podofilotoxine wie Epidophilotoxine (VP-16) und Teniposid (VM-26) bilden einen Komplex mit Topoisomerase II. Sie werden unter anderem gegen Lunge, Hodenkrebs, Leukämie, Lymphome, Eierstockkrebs, Brustkarzinom und maligne intrakranielle Tumoren angewendet. Sind aus Pflanzen isoliert Podophyllum Notatum Und P. Peltatum.
Camptotecinas -Analoga
Campotecinas sind Verbindungen, die die Topoisomerase I hemmen, und darunter die Irinotecan, die Topote.
Diese Verbindungen wurden gegen Dickdarm-, Lungen- und Brustkrebs verwendet und werden natürlich aus der Kruste und den Blättern der Baumarten gewonnen Camptotheca Accuminata des chinesischen und Tibetkornkleides.
Natürliche Hemmung
Strukturelle Veränderungen der Topoisomerasen I und II können auch ganz auf natürliche Weise auftreten. Dies kann bei einigen Ereignissen passieren, die Ihren katalytischen Prozess beeinflussen.
Unter diesen Veränderungen kann die Bildung von Pyrimidindurchmessern, die Nichtübereinstimmung von Stickstoffbasen und andere durch oxidativen Stress verursachte Ereignisse zitiert werden.
Verweise
- Liu, l. F. (1994). DNA-Topoisomerase: Topoisomerase-Targeting-Medikamente. Akademische Presse. S. 307
- Osheroff, n. und Bjorsti, m. (2001). DNA Topoisomerase. Enzymologie und Drogen. Vol. Ii. Menschliche Presse. S. 329.
- « Makrophyteneigenschaften, Lebensraum, Klassifizierung und Bedeutung
- 20 Erfindungen der Renaissance, die die Welt veränderte »

