Transaminierung
- 2152
- 4
- Rieke Scheer
 Schema einer Aminotranerzise-Reaktion zwischen einer Aminosäure und einer Alpha-Zoazid (Quelle: Alcibiades über Wikimedia Commons)
Schema einer Aminotranerzise-Reaktion zwischen einer Aminosäure und einer Alpha-Zoazid (Quelle: Alcibiades über Wikimedia Commons) Was ist Transaminierung?
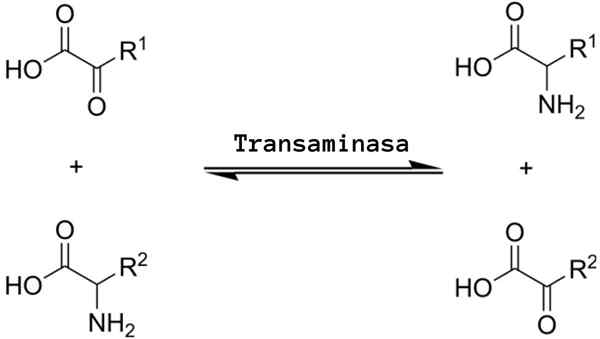
Der Transaminierung Es ist eine Art chemischer Reaktion, die in der "Umverteilung" der Aminosäuregruppen wirkt, da sie reversible Aminierungsprozesse (Zugabe einer Aminogruppe) und Herzschmerz (Eliminierung einer Aminogruppe) umgibt, die durch spezifische Enzyme katalysiert werden bekannt als Transaminasen oder Aminotransferasen.
Die allgemeine Transaminierungsreaktion impliziert den Austausch zwischen einer Aminosäure und jedem α-Zo-Schuss, bei dem der Austausch einer Amino-Gruppe die Ketoacid-Version des ersten Substrat-Aminosäure und die Aminosäureversion des ersten α-Zo-Ecotoacid-Substrats erbringt.
Die normalerweise ausgetauschte Amino -Gruppe ist das Amino "Alpha", dh derjenige, der an der Bildung der Peptidverbindungen teilnimmt und die Struktur der Aminosäuren definiert, obwohl Reaktionen, die andere Aminogruppen betreffen Verschiedene Positionen können in auftreten.
Mit Ausnahme von Lysin, Treonin, Prolin und Hydroxyprolin sind alle Aminosäuren an Transaminierungsreaktionen teil.
Die Transamierungsreaktionen zwischen Aminosäuren und α-Cethoacids wurden 1937 von Braunstein und Kritzmann entdeckt, und seitdem wurden sie intensive Studien unterzogen, da sie in vielen Stoffen verschiedener Organismen und mit unterschiedlichen Zwecken auftreten.
Beim Menschen sind beispielsweise Transaminasen in Körpergeweben weit verbreitet und sind besonders im Herzmuskelgewebe, in der Leber, im Skelettmuskelgewebe und in den Nieren aktiv.
Reaktionsmechanismus
Transaminierungsreaktionen implizieren mehr oder weniger den gleichen Mechanismus. Wie oben erwähnt, treten diese Reaktionen als reversibler Austausch einer Aminogruppe zwischen einer Aminosäure und einer α-ZO-CID auf.
Kann Ihnen dienen: Keramikmaterialien: Eigenschaften, Typen, BeispieleDiese Reaktionen hängen von einer Verbindung ab, die als Phosphat-Pyridoxal bekannt ist, ein Derivat von Vitamin B6, das als Aminogruppentransporter beteiligt ist und an Transaminase-Enzymen durch die Bildung einer Schiffsbase zwischen der Aldehydgruppe dieses Moleküls und des ε-Amino von a bindet Lysinrest am aktiven Zentrum des Enzyms.
Die Vereinigung zwischen dem Phosphat -Pyridoxal und dem Lysinrest am aktiven Zentrum ist nicht kovalent, sondern wird durch elektrostatische Wechselwirkung zwischen der positiven Last von Stickstoff in Lysin und der negativen Belastung in der Phosphatgruppe der Pyridoxal angegeben.
Im Verlauf der Reaktion verdrängt die Aminosäure, die als Substrat fungiert.
In der Zwischenzeit wird ein Paar Aminosäure-Alpha-Kohlenstoffelektronen entfernt und in den Pyridinring übertragen, der das Phosphat-Pyridoxal (mit einer positiven Ladung) zusammenstellt.
Auf diese Weise beteiligt sich das pyridoxale Phosphat nicht nur am Transfer oder Transport der Aminosäuren zwischen den Aminosäuren und den α-Ecotoaciden, die Substrat der Transaminasen sind, aber auch als „Saken“ von Elektronen fungiert und die Dissoziation von erleichtert der Alfasäure -Wasserstoff.
Zusammenfassend überträgt das erste Substrat, eine Aminosäure, seine Aminogruppe an das Phosphat-Pyridoxal, aus dem sie anschließend in das zweite Substrat, ein α-Zo-Ecotoid, in das Zwischenprodukt übertragen wird, im Zwischenprodukt, der als Pyridoxamin bekannt ist, bekannt als Pyridoxamin Phosphat.
Kann Ihnen dienen: SäulenchromatographieTransaminierungsfunktion
Transaminase -Enzyme werden im Allgemeinen in Cytosol und Mitochondrien gefunden und arbeiten in der Integration verschiedener Stoffwechselstrecken.
Glutamatdehydrogenase kann beispielsweise in seiner inversen Reaktion Glutamat in Ammonium, NADH (oder NADPH) und α-Zetoglutarat verwandeln, die in den Zyklus von Trikarbonsäuren in die Energieerzeugung gelangen können.
Dieses Enzym, das sich in der mitochondrialen Matrix befindet Zweck.
Die Bildung des Enzyms (Glutamat -Dehydrogenase) während der Gehirnentwicklung ist für die Kontrolle der Ammoniumentgiftung wesentlich, da gezeigt wurde das ist schädlich für die Gehirngesundheit.
In einigen Leberzellen -Transaminierungsreaktionen können auch für die Gluconeogenese -Glucosesynthese verwendet werden.
Glutamin wird durch Glutaminase -Enzym in Glutamat und Ammonium umgewandelt. Dann wird Glutamat in α-Zetoglutarat umgewandelt, das in den Krebszyklus und dann in die Gluconeogenese eintritt. Dieser letzte Schritt erfolgt dank des Malo, eines der Produkte auf der Route, über die Mitochondrien mit einem Shuttle transportiert.
Dieses Shuttle verlässt α-Cethooglutarat des Málica-Enzyms, das es Pyruvat macht. Zwei Pyruvatmoleküle können dann ein Glucosemolekül durch Glukoneogenese umgewandelt werden.
Kann Ihnen dienen: Flacher HintergrundflascheBeispiele
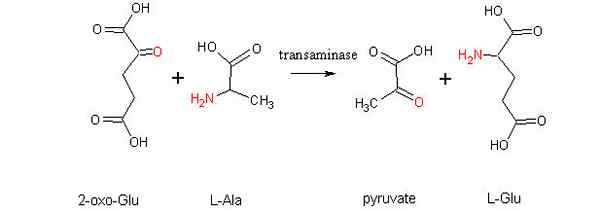
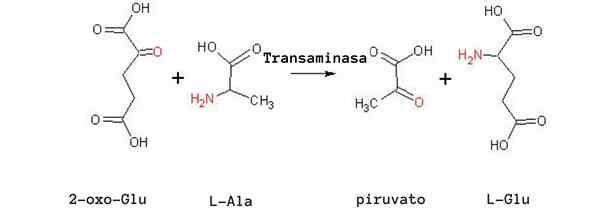
Die häufigsten Transaminierungsreaktionen hängen mit Alanin -Aminosäuren, Glutaminsäure und Asparaginsäure zusammen.
Einige Aminotransferase-Enzyme können zusätzlich zu Pyridoxalphosphat Pyruvat als "Coenzym" verwenden, wie es bei Transaminase Glutamat-Piruvat der Fall ist, das die folgende Reaktion katalysiert:
Glutamat + Pyruvat ↔ Alanin + α-Cetoglutarat
Muskelzellen hängen von dieser Reaktion ab, um Alanin aus Pyruvat zu produzieren und Energie durch den Krebszyklus mittels α-Zetoglutorat zu erhalten. In diesen Zellen hängt die Verwendung von Alanin als Energiequelle von der Eliminierung von Aminogruppen als Ammoniumionen in der Leber durch den Harnstoffzyklus ab.
 Alanin -Transaminierungsreaktion (Quelle: Tomas Drab [öffentlich zugänglich] über Wikimedia Commons)
Alanin -Transaminierungsreaktion (Quelle: Tomas Drab [öffentlich zugänglich] über Wikimedia Commons) Eine weitere sehr wichtige Transaminierungsreaktion bei verschiedenen Spezies ist die katalysierte durch das Enzymaspartat Aminotransferase:
L-Spartato + α-Ketoglutarat ↔ Oxalacetat + L-Glutamat
Schließlich, aber nicht zuletzt die γ-Aminobuttersäure-Transaminierungsreaktion (GABA), eine Nicht-Protein-Aminosäure für das Zentralnervensystem, das als hemmender Neurotransmitter fungiert. Die Reaktion wird durch eine γ-Aminobutire-Transaminase-Säure katalysiert und ist mehr oder weniger wie folgt:
α-Ketoglutarat + 4-Aminobutansäure ↔ Glutamat + Succinic Semi-Car
Das Semi -Use von Succinic Semi wird durch eine Oxidationsreaktion in Succinsäure umgewandelt, und letztere kann in den Krebszyklus für die Energieerzeugung eintreten.

