Transformationen der Materie
- 2694
- 305
- Nick Laurén
 Die Transformationen der Materie sind jene Transformationen, die es leidet, ohne ihre Zusammensetzung zu ändern. Zum Beispiel bleibt Wasser in seiner flüssigen, festen (Eis) oder Soda (Dampf) Wasser Wasser
Die Transformationen der Materie sind jene Transformationen, die es leidet, ohne ihre Zusammensetzung zu ändern. Zum Beispiel bleibt Wasser in seiner flüssigen, festen (Eis) oder Soda (Dampf) Wasser Wasser Was sind die Transformationen der Materie??
Die Transformationen der Materie sind die Veränderungen, die dies leiden, ohne dass sich die Zusammensetzung ändert. Das heißt, Materie wird verwandelt, wenn sie physikalische und chemische Veränderungen durchläuft.
Beispiele für physikalische Veränderungen sind die Bildung von Eis, wenn die Temperatur abfällt, der Tau auf den Blättern, der am Morgen auftritt, die Dilatation der Objekte beim Erhitzen und die Magnetisierung eines Körpers.
Die Oxidation von Schrauben und Nägeln ist für seinen Teil eine chemische Veränderung, da Oxid eine Substanz ist, die sich vom ursprünglichen Eisen unterscheidet. In jedem Fall sind Energieänderungen erforderlich, damit diese Transformationen stattfinden.
ICE -Transformation ist eine Zustandsänderung, in der sich Wasser verfestigt, aber es gibt mehr Möglichkeiten. Materie tritt in der Natur und im Labor in verschiedenen Zuständen auf, von denen Gas, Flüssigkeit und Feste die drei am häufigsten sind, zumindest unter irdischen Bedingungen.
Da sich die Materie jedoch ändert.
Es kann bestätigt werden, dass es fünf grundlegende Materiezustände gibt:
- Solide
- Flüssig
- Gas
- Plasma
- Bose-Einstein-Kondensat
Von diesen sind die ersten drei unter den Bedingungen unseres Planeten stabil, während die letzten beiden technologische Mittel erfordern, obwohl sie im Universum häufig sind. Plasma ist in der Tat der häufigste Zustand der Materie im Kosmos.
Die grundlegenden Zustände der Materie
Unter den Druck- und Temperaturbedingungen der Erde wird die Materie normalerweise in drei Zuständen dargestellt: Feststoff, Flüssigkeit und Gas, während das Plasma und Kondensatzustände von Bose-Einstein unter verschiedenen Bedingungen erhalten werden, die im Labor erreicht werden können.
Kann Ihnen dienen: unkonventionelle MaßnahmenUm zu erklären, warum es notwendig ist, sich daran zu erinnern. Anziehungskräfte, wie der Name schon sagt, neigen dazu, die Partikel zusammenzustellen, während die abstoßenden die entgegengesetzten Wirkung haben.
Feststoffe, Flüssigkeiten und Gase
Wenn die Kräfte der Anziehung zwischen den Partikeln herrschen, bleiben sie zusammen in mehr oder weniger festen Positionen nahe beieinander, wodurch die entsteht Feststoffe. Die Partikel können vibrieren, aber ihre Position innerhalb des Feststoffs nicht aufgeben. Daher behält dies eine definierte Form und ein definiertes Volumen bei.
Im Flüssigkeiten, Anziehungskräfte ermöglichen es Partikeln. Aus diesem Grund passen Flüssigkeiten ihre Form an den Container an, der sie enthält, aber ihr festes Volumen beibehalten.
Schließlich in der Gase, Attraktive Kräfte sind noch schwächere, überwiegend Abstoßungskräfte. Dies lässt die Partikel voneinander entfernt und mit viel mehr Bewegungsfreiheit fernhalten. Aus diesem Grund expandieren die Gase, bis das verfügbare Volumen vollständig einnimmt.
Bose-Einstein-Kondensat und Kondensat
Durch ausreichend Heizen von Gas trennen sich Ionen und Elektronen in einem Prozess genannt Ionisation, Auf diese Weise a Plasma im Labor. Der Plasmazustand ist nicht leicht in der Nähe der Erde zu sehen.
Dieses schöne natürliche Phänomen tritt auf.
Am anderen Ende der Skala, die viel über dem absoluten Null kühlt, erscheint ein neuer Materiezustand, in dem sich die meisten Partikel im grundlegenden Zustand befinden, was die niedrigste Energie ist.
Es kann Ihnen dienen: Wichtigster Aspekt der kleinen Wissenschaft, großartiger Wissenschaft und TechnowissenschaftDieser Zustand der Materie wird genannt Bose-Einstein-Kondensat, von Physikern Satyendra Bose und Albert Einstein, die ihre Existenz 1924 vorhergesagt hatten.
Viele Jahre später, 1995, gelang es mehreren Wissenschaftlern, sehr verdünnte Gase in diesen Zustand zu tragen, eine leichte Aufgabe, wenn man bedenkt, dass über dem absoluten Null die Temperaturen von nur Nano-Kelvin erforderlich sind.
Zustandsänderungen in dieser Angelegenheit
In der Natur ist es sehr häufig, dass die Materie von einem Staat in einen anderen übergeht. Normalerweise sind diese physikalischen Veränderungen auf Druck- und Temperaturschwankungen zurückzuführen, die aus der Erhöhung oder Abnahme der Partikelergie abgeleitet sind.
Wenn einem Material thermische Energie zugesetzt wird, nimmt die kinetische Energie ihrer Partikel zu und verringert die Anziehungskraft, die sie im Zusammenhang mit dem Kohäsion hält. Wenn sich das Material im festen Zustand befand, kann es in den flüssigen Zustand gehen oder sogar direkt zum gasförmigen Zustand gehen.
Im Gegenteil, dass es möglich ist, genügend thermische Energie zu entfernen, ist es möglich, eine gasförmige Material in Flüssigkeit zu verwandeln, oder dass es von Flüssigkeit zu Feststoff verläuft. In jedem Fall ändert sich die Zusammensetzung der Substanz nicht.
Das bekannteste Beispiel für alles ist Wasser: Es ist bekannt.
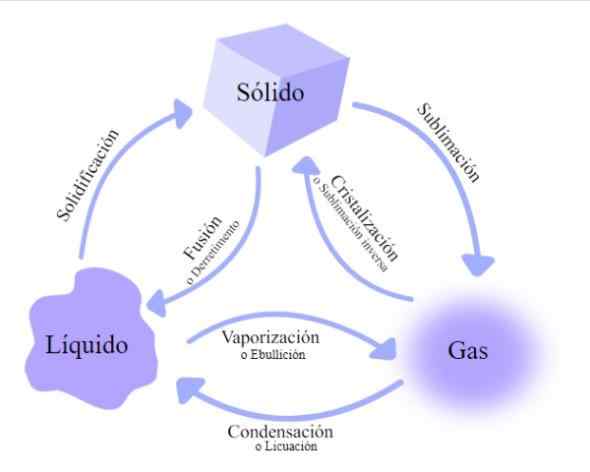 Änderungen im Zustand der Materie. Quelle: Wikimedia Commons
Änderungen im Zustand der Materie. Quelle: Wikimedia Commons Es gibt mehrere Wechselkurse, durch die Materie verabschiedet wird, die nach der Anstiege oder Abnahme der Wärmeenergie klassifiziert sind:
- Progressiv, Sie finden statt, wenn das Material Wärmeenergie absorbiert.
- Regressiv, Sie sind diejenigen, die auftreten, wenn das Material Energie liefert.
Progressive Transformationen
Unter den verschiedenen fortschrittlichen Transformationen, die durch Zugabe von Energie in dieser Angelegenheit stattfinden, sind:
Verschmelzung
Änderungen, die auftreten, wenn das Material von seiner festen Phase zu seiner flüssigen Phase übergeht. Zum Beispiel durch Schmelzen eines Eisblocks oder einer Wärme oder eines Wachs in einer Pfanne.
Verdampfung
In diesem Fall wird die Angelegenheit durch den flüssigen Zustand in den gasförmigen Zustand umgewandelt.
Kann Ihnen dienen: MethodikDie Verdampfung erfolgt auf zwei Arten:
- Sieden, findet statt, wenn das Material seine erreicht Kochtemperatur, Auf diese Weise reicht Energie aus, um intermolekulare Kräfte zu überwinden, die Partikel in ihrem flüssigen Zustand halten. Jede Substanz hat eine charakteristische Siedetemperatur bei einem bestimmten Druck.
- Verdunstung, Nur oberflächliche Partikel ändern den Zustand, da das Material nicht auf der Temperatur steht, die für das Kochen erforderlich ist. Das bekannteste Beispiel ist die Verdunstung von Wasser in einem Behälter bei Raumtemperatur.
Verflüchtigung
Auch genannt Sublimation, Es findet statt, wenn das Material direkt aus Gasfest bewegt, ohne die flüssige Phase zu durchlaufen.
Zum Beispiel ist Trockeneis Kohlendioxid2 bei Raumtemperatur verflüchtigt. Naphthalin, das zum Schutz von Insektenkleidung verwendet wird, wird langsam von fest zu einem Gas sein.
Ionisation
Es ist der Durchgang eines Plasmagases.
Regressive Transformationen
Sind die Transformationen, die durch die Abnahme der thermischen Energie der Partikel verursacht werden. Unter ihnen sind:
Erstarrung
Es ist die Änderung der Materie vom flüssigen Zustand zum Feststoff durch Abkühlen, wie es beim Platzieren von Wasser in den Gefrierschrank auftritt. Der Prozess liegt daran, dass die Substanz der kalten Umgebung Energie liefert und Eis bildet.
Kondensation
Es tritt beim Übergang vom gasförmigen Zustand in die flüssige Phase auf, wie beim Wasserdampf in der Luft, wenn er mit der kalten Oberfläche der Autowindscheibe in Kontakt tritt.
Verflüssigung
Es ist die Umwandlung der Materie beim Übergang von Gas zu Flüssigkeit, wie es passiert, Kühlung Ammoniak oder Kohlendioxid mit hohem Druck.
Inverse Sublimation
Dies ist der Durchgang der Materie in einem gasförmigen bis festen Zustand, wie bei dem gasförmigen Jod, das gegen eine kalte Oberfläche zusammenspricht, was zur Bildung von festen Kristallen führt. Es ist auch als bekannt als Kristallisation.
Dessionisierung
Änderung des Plasmazustands in den gasförmigen Zustand.
Verweise
- Chang, R. (2013). Chemie. 11va. Auflage. McGraw Hill Education.
- Giancoli, d. (2006 =. Physik: Prinzipien mit Anwendungen. 6. Ed Prentice Hall.
- Materie und seine Eigenschaften. Erholt von: Elbibliote.com.
- Opentax. Chemie. Abgerufen von: openStax.Org.
- Shipman, j. (2009). Eine Einführung in die Physik. Zwölfte Ausgabe. Brooks/Cole, Cengage Editions.

