Treonineigenschaften, Funktionen, Verschlechterung, Vorteile
- 4589
- 1191
- Lewis Holzner
Der Treonina (Thr, T) oder Treo-α-Amino-β-Butmazsäure ist eine der Bestandteile von Aminosäuren von Zellproteinen. Da Menschen und andere Wirbeltiere keine Biosyntheserouten für seine Produktion haben, gilt Treonin als eine der 9 essentiellen Aminosäuren, die mit der Ernährung erworben werden müssen.
Treonin war das letzte der 20 gewöhnlichen Aminosäuren, die in Proteinen entdeckt wurden, eine Tatsache, die mehr als ein Jahrhundert nach der Entdeckung von Sparagin (1806) in der Geschichte stattfand, der ersten Aminosäure beschrieben wurde.
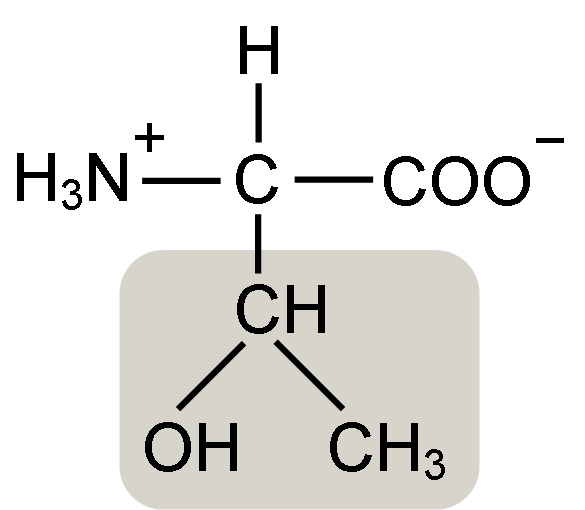
 Treonin-Aminosäurestruktur (Quelle: Keycin [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Treonin-Aminosäurestruktur (Quelle: Keycin [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) Es wurde 1936 von William Cumming Rose entdeckt, der den Begriff "Treonin" für die strukturelle Ähnlichkeit zwischen dieser Aminosäure und Haraonsäure geprägt hatte, einer Verbindung, die aus Treose -Zucker stammt.
Als Aminosäureprotein hat Treonin mehrere Funktionen in den Zellen, darunter die Bindungsstelle für Kohlenhydratketten, die für Glykoproteine typisch sind.
In ähnlicher Weise ist Treonin ein wesentlicher Bestandteil von Proteinen wie Zahnschmelz, Elastin und Kollagen und hat auch wichtige Funktionen im Nervensystem. Es wird als Nahrungsergänzung und als "Mitigator" der physiologischen Zustände von Angst und Depression verwendet.
[TOC]
Eigenschaften
Das Treonin gehört zur polaren Aminosäuregruppe, deren R- oder Seitenkettengruppe ohne positive oder negative Belastungen (nicht geladene polare Aminosäuren) fehlt.
Die Eigenschaften ihrer R -Gruppe werden von einer hochlöslichen Aminosäure (hydrophil oder hydrophil) hergestellt, was auch für die anderen Mitglieder dieser Gruppe wie Cystein, Serin, Sparagin und Glutamin gilt.
Zusammen mit Tryptophan, Phenylalanin, Isoleucin und Tyrosin ist Treonin eine der fünf Aminosäuren, die sowohl glukogene als auch ketogene Funktionen aufweisen, da es aus seinem Stoffwechsel relevante Vermittler wie Pyruvat und Succinyl-CoA gibt.
Diese Aminosäure hat ein ungefähres Molekulargewicht von 119 g/mol; Wie viele der Aminosäuren ohne Last hat es einen isoelektrischen Punkt um 5.87 und seine Häufigkeit in Proteinstrukturen liegt nahe bei 6%.
Einige Autoren gruppieren das Treonin zusammen mit anderen Aminosäuren des "süßen" Geschmacks, darunter auch die Serin, Glycin und Alanin.
Struktur
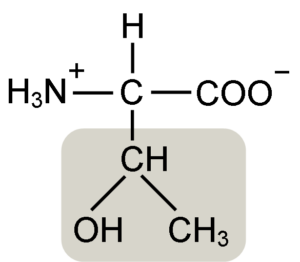
Α-Aminosäuren wie Treonin haben eine allgemeine Struktur, dh es ist für alle häufig. Dies wird durch das Vorhandensein eines Kohlenstoffatoms unterschieden.
Dieser Kohlenstoff teilt eine seiner Bindungen mit einem Wasserstoffatom, einer anderen mit der R -Gruppe, die für jede Aminosäure charakteristisch ist, und die anderen beiden sind von den Aminogruppen (NH2) und Carboxyl (COOH) besetzt, die für alle üblich sind Die Aminosäuren.
Die Tonine -Gruppe R verfügt über eine Hydroxylgruppe, die es ihm ermöglicht, Wasserstoffbrücken mit anderen Molekülen in wässrigen Medien zu bilden. Seine Identität kann als alkoholische Gruppe (ein Ethanol mit zwei Kohlenstoffatomen) definiert werden, das eines ihrer Hydrogene verloren hat, um sich dem Kohlenstoffatom α (-CHAH-CH3) anzuschließen.
Diese Gruppe -OH kann als "Brücke" oder Gewerkschaftsstelle für eine Vielzahl von Molekülen dienen (dies kann beispielsweise während der Bildung von Glykoproteinen mit Oligosaccharidenketten verbunden werden), daher ist sie eine derjenigen die modifizierten Treoninderivate.
Die biologisch aktive Form dieser Aminosäure ist L-Treonin und dies beteiligt sich sowohl an der Bildung von Proteinstrukturen als auch an den verschiedenen Stoffwechselprozessen, in denen sie wirkt.
Funktionen
Als Aminosäureprotein ist Treonin Teil der Struktur vieler Proteine in der Natur, wo seine Bedeutung und sein Wohlstand von der Identität und Funktion des Proteins abhängen, zu dem es gehört.
Kann Ihnen dienen: Heterose: Verbesserung bei Tieren, in Pflanzen, menschlichem WesenZusätzlich zu seinen strukturellen Funktionen bei der Bildung der Peptidsequenz von Proteinen erfüllt Treonin andere Funktionen sowohl im Nervensystem als auch in der Leber, wo es am Metabolismus von Fetten beteiligt ist und die Akkumulation in diesem Organ in diesem Organ verhindert.
Treonin ist Teil der Sequenzen, die von den Enzymen Serín/Treonina -Kinasen erkannt werden, die für zahlreiche Proteinphosphorylierungsprozesse verantwortlich sind, was für die Regulation der Multiplizität von Funktionen und intrazellulären Signalereignissen von entscheidender Bedeutung ist.
Es wird auch zur Behandlung einiger Darm- und Verdauungsstörungen verwendet, und deren Nützlichkeit bei der Abschwächung pathologischer Erkrankungen wie Angst und Depression wurde nachgewiesen.
L-Treonin ist ebenfalls eine der Aminosäuren am Expression von Genen beteiligt.
In der Industrie
Eine gemeinsame Eigenschaft für viele Aminosäuren ist die Fähigkeit, mit anderen chemischen Gruppen wie Aldehyde oder Ketonen zur Bildung der charakteristischen "Aromen" vieler Verbindungen zu reagieren.
Unter diesen Aminosäuren ist das Treonin, das als Serin während des TOS mit Saccharose reagiert.
Treonin ist in vielen Arzneimitteln natürlicher Herkunft und auch in vielen Formulierungen von Nahrungsergänzungsmitteln vorhanden, die Patienten mit Unterernährung verschrieben werden oder in dieser Aminosäure schlechte Ernährung haben.
Eine weitere der bekanntesten Funktionen von L-Treonin, und das im Laufe der Zeit gewachsen ist, ist additiv bei der Zubereitung konzentrierter Lebensmittel für Schweine und Geflügelproduktionsindustrie.
L-Treonin wird in diesen Branchen als Nahrungsergänzung in schlechten Formulierungen aus Protein-Sicht verwendet.
Die Hauptform der Produktion dieser Aminosäure erfolgt normalerweise durch mikrobielle Fermentation und Weltproduktionszahlen für landwirtschaftliche Zwecke für das Jahr 2009 über 75 Tonnen.
Biosynthese
Treonin ist eine der neun essentiellen Aminosäuren für den Menschen, was bedeutet, dass sie nicht von Körperzellen synthetisiert werden kann und daher aus Proteinen aus tierischen oder pflanzlichen Ursprungs erworben werden muss, die mit der täglichen Ernährung geliefert werden.
Pflanzen, Pilze und Bakterien synthetisieren Treonin aus ähnlichen Routen, die einige Unstimmigkeiten miteinander aufweisen können. Die meisten dieser Organismen beginnen jedoch von Asparto als Vorläufer, nicht nur für Treonin, sondern auch für Methodin und Lysin.
Biosintheseweg in Mikroben
Der Biosyntheseweg von L-Treonin in Mikroorganismen wie Bakterien besteht aus fünf Schritten, die durch verschiedene Enzyme katalysiert werden. Das Abflugsubstrat ist, wie kommentiert.
Diese Reaktion erzeugt das Metabolit-L-Asphat-Phosphat (L-Aspartil-P), das als Substrat für die semiiadehydische Aspartylenzym-Dehydrogenase dient, die ihre Umwandlung in semi-theabhängige semi-the-abhängige Aspartyles katalysiert.
Semiiardhaid-Aspartyl kann sowohl für die Biosynthese von L-Lisin als auch für die Biosynthese von L-Treonin verwendet werden; In diesem Fall wird das Molekül von einem Homoserin-Enzym NADPH-abhängigen Abhängigkeit für die Produktion von L-Homoserina verwendet.
Das L-Homoserin wird durch eine Homoserin-ATP-abhängige Kinase und das Reaktionsprodukt, das in Turn in der Lage ist, L-Trinina zu synthetisieren.
L-Methionin kann aus dem im vorherigen Schritt hergestellten L-Homoserin synthetisiert werden, sodass es eine „wettbewerbsfähige“ Route für die Synthese von L-Treonin darstellt.
Das synthetisierte L-Treonin kann auf diese Weise für die Proteinsynthese verwendet werden oder auch stromabwärts für die Synthese von Glycin und L-Leucin verwendet werden, zwei relevante Aminosäuren auch aus Protein-Sicht.
Kann Ihnen dienen: EvolutionstheorienVerordnung
Es ist wichtig hervorzuheben, dass drei der fünf Enzyme, die an der Biosynthese von L-Treonin in Bakterien teilnehmen, durch das Produkt der Reaktion durch negative Rückkopplung reguliert werden. Dies sind das Kinase -Aspartat, die Homoserin -Dehydrogenase und die Homoserinkinase.
Darüber hinaus hängt die Regulierung dieser Biosyntheseweg auch von den zellulären Anforderungen der anderen damit verbundenen biosynthetischen Produkte ab, da die Bildung von L-Lisine, L-Methionin, L-Isoleucin und Glycin von der Produktionsstrecke der Produktion von Produktion von abhängig ist L-Treonine.
Degradierung
Treonin kann durch zwei verschiedene Routen abgebaut werden, um Pyruvat oder Succinyl-CoA zu produzieren. Letzteres ist das wichtigste Produkt des Treonin -Katabolismus beim Menschen.
Der Treonin -Metabolismus tritt hauptsächlich in der Leber auf. Diese Route beginnt mit dem Transport der Aminosäure durch die Plasmamembran der Hepatozyten mittels spezifischer Transporter.
Pyruvatproduktion aus Treonin
Die Umwandlung von Treonin in Pyruvat erfolgt dank seiner Umwandlung in Glycin, die in zwei katalytischen Schritten stattfindet, die mit der Bildung von 2-Amino-3-E-Ecotobutirat aus dem Treonin und durch die Wirkung des Enzyms Treonin-Dehydrogenase beginnen.
Im Menschen entspricht dieser Weg nur zwischen 10 und 30% des Katabolismus des Treonin, seine Bedeutung ist jedoch relativ zum Organismus, der beispielsweise bei anderen Säugetieren berücksichtigt wird, dies ist beispielsweise viel relevanter katabolisch sprechend.
Succinil-CoA-Produktion aus Treonina
Wie bei Metionin, Valina und Isoleucin werden auch die Kohlenstoffatome von Treonin für die Succunil-CoA-Produktion verwendet. Dieser Prozess beginnt mit der Umwandlung der Aminosäure in α-Cethobutirat, das anschließend als Substrat des α-Zo-Schuss-Dehydrogenase-Enzyms zur Durchführung von Propionil-CoA verwendet wird.
Die Umwandlung von Treonin in α-Cethobutirat wird durch das Enzym-Dehydratase katalysiert, was den Verlust eines Wassermoleküls (H2O) und eines weiteren Ammoniumions (NH4+) impliziert.
Propionyl-CoA wird durch eine zweistufige Reaktion, die den Eintritt eines Bicarbonat-Kohlenstoffatoms erfordert, in Methylmalonyl-CoA carboxyliert (HCO3-). Dieses Produkt dient als Substrat für ein Methylmalonil-CoA-Mutasa-Coenzym B12-abhängig, das das Molekül zur Herstellung von Succinyl-CoA "epimerisiert".
Andere katabolische Produkte
Darüber hinaus kann das Kohlenstoffskelett von Treonin katabolisch für die Herstellung von Acetyl-CoA verwendet werden, was auch wichtige Auswirkungen aus der Sicht des Energieverhältnisses in Körperzellen hat.
In bestimmten Organismen fungiert Treonin auch als Substrat einiger Biosynthesewege wie Isoleucin, zum Beispiel. In diesem Fall kann durch 5 katalytische Schritte α-Ecthobutirat aus dem Katabolismus von Treonin auf die Bildung von Isoleucin gerichtet werden.
Lebensmittel, die reich an Treonine sind
Obwohl die meisten der reichlich vorhandenen Lebensmittel im Protein einen bestimmten Prozentsatz aller Aminosäuren haben, wurde festgestellt, dass Eier, Milch, Soja und Gelatine besonders reich an der Treonin -Aminosäure sind.
Treonin ist auch in Tierfleisch wie Hühnchen, Schwein, Kaninchen, Lamm und verschiedenen Arten von Vögeln. In Food of Plant -Ursprung ist es in den Cholen, auf Zwiebel, Knoblauch, Mangold und Auberginen reich.
Es ist auch in Reis, Mais, Weizenkleie, Hülsenfrüchten und in vielen Früchten wie Erdbeeren, Bananen, Trauben, Ananas, Pflaumen und anderen Nüssen wie Nüssen oder Pistachios zu finden.
Vorteile Ihrer Aufnahme
Nach Angaben des Expertenausschusses der Weltgesundheitsorganisation für Landwirtschaft und Lebensmittel (WHO, FAO) beträgt die tägliche Bedarf an durchschnittlich erwachsenen Menschen in Treonina etwa 7 mg pro Kilogramm Körpergewicht, die aus der Ernährung von Lebensmitteln erworben werden muss.
Kann Ihnen dienen: Rot des Phenols: Eigenschaften, Vorbereitung, AnwendungenDiese Zahlen stammen aus experimentellen Daten aus Studien, die mit Männern und Frauen durchgeführt wurden, wobei diese Menge an Treonin ausreicht, um ein positives Stickstoff -Gleichgewicht in Körperzellen zu erhalten.
Studien mit Kindern zwischen 6 Monaten und einem Jahr haben jedoch gezeigt.
Zu den Hauptvorteilen der Aufnahme von Nahrungsergänzungsmitteln oder Medikamenten mit speziellen Formulierungen, die reich an L-Treonin sind.
Zusätzliche Treoninversorgung bevorzugt die Absorption von Nährstoffen im Darm und trägt auch zur Verbesserung der Leberfunktionen bei. Es ist auch wichtig für den Transport von Phosphatgruppen durch Zellen.
Mangelerkrankungen
Bei kleinen Kindern gibt es geboren.
Mängel in dieser Aminosäure wurden mit einigen Fehlern in Bezug.
Menschen, die in Treonina schlechte Diäten ausgesetzt sind.
Verweise
- Barret, g., & Elmore, D. (2004). Aminosäuren und Peptide. Cambridge: Cambridge University Press.
- Borgonha, s., Regan, m. M., Oh s. H., Condon, m., & Jung, v. R. (2002). Threonin-Anforderung von gesunden Erwachsenen, der mit 24-h-Indikator-Aminosäure-Gleichgewichtstechnik der. American Journal of Clinical Nutrition, 75(4), 698-704.
- Bradford, h. (1931). Die Geschichte der Entdeckung der Aminosäuren. Ii. Eine Überprüfung der seit 1931 beschriebenen Aminosäuren als Komponenten nativer Proteine. Fortschritte in der Proteinchemie, 81-171.
- Champe, p., & Harvey, r. (2003). Aminosäuren Aminosäuren. In Lippincotts illustrierte Bewertungen: Biochemie (3. ed., pp. 1-12). Lippincott.
- De lange, c. F. M., Gillis, a. M., & Simpson, G. J. (2001). Einfluss der Threonin-Einnahme auf die Ablagerung des Whoe-Körper-Proteins und die Dreionin-Nutzung bei wachsenden Schweinen, die gereinigte Diäten gefüttert haben. Journal of Animal Science, 79, 3087-3095.
- Edelman, a., Blumenthal, d., & Krebs und. (1987). Serin/Threonin -Kinaseprotein. Annu. Rev., 56, 567-613.
- Edsall, J. (1960). Aminosäuren, Proteine und Krebsbiochemie (Vol. 241). London: Academic Press, Inc.
- Haus, j. D., Hall, b. N., & Brosnan, J. T. (2001). Threonin -Metabolismus in isolierten Rattenhepatozyten. American Journal of Physiology - Endokrinologie und Stoffwechsel, 281, 1300-1307.
- Hudson, geb. (1992). Biochemie von Lebensmittelproteinen. Springer-Science+Business Media, b.V.
- Kaplan, m., & Flavin, m. (1965). Threonine Biosynthese. Auf dem Weg in Pilzen und Bakterien und dem Mechanismus der Isomerisierungsreaktion. Das Journal of Biological Chemistry, 240(10), 3928-3933.
- Kidd, m., & Kerr, b. (neunzehn sechsundneunzig). L-Threonine für Geflügel: eine Bewertung. Angewandte Geflügelwissenschaft, Inc., 358-367.
- Pratt, e., Snyderman, s., Cheung, m., Norton, p., & Holt und. (1954). Die Dreioninanforderung des normalen Kindes. Das Journal of Nutrition, 10(56), 231-251.
- Rigo, j., & Senterre, J. (1980). Optimale Threonin -Aufnahme für Frühgeborene, die mit oraler oder parenteraler Ernährung befördert werden. Journal of Parenteral und Enteral Nutrition, 4(1), 15-17.
- Shyh-Chang, n., Locasale, j. W., Lysssiotis, c. ZU., Zheng und., Teo, r. UND., Ratanasirintrawoot, s.,... Cantley, l. C. (2013). Einfluss des Threonin-Metabolismus auf S-Adenensylmethionin- und Histonmethylierung. Wissenschaft, 339, 222-226.
- Vickery, h. B., & Schmidt, C. L. ZU. (1931). Die Geschichte der Entdeckung der Aminosäuren. Chemische Bewertungen, 9(2), 169-318.
- MD Web. (N.D.). Abgerufen am 10. September 2019 von www abgerufen.Webmd.com/vitamine/ai/Inhaltsmono-1083/Threonin
- Wormer, e. H., & Pardee, zu. B. (1958). Regulierung der Threonin -Biosynthese in Escherichia coli. Archiv für Biochemie und Biophysik, 78(2), 416-432.
- Xunyan, x., Quinn, p., & Xiaoyuan, x. (2012). Forschungstor. Abgerufen am 10. September 2019 von www abgerufen.ResearchGate.net/figur/the-biosynthese-pathway-of-l-threonin-the-pathway-Konsisten von Fi-ve-Enzymmatik-Steps_FIG1_232320671

