Triethilaminstruktur, Eigenschaften, Verwendung und Risiken

- 3331
- 203
- Joy Hort
Der Triethilamin Es ist eine organische Verbindung, genauer gesagt ein aliphatisches Amin, dessen chemische Formel n ist (CH2CH3)3 oder Netz3. Wie andere flüssige Amine zeigt es einen Geruch, ähnlich dem des mit Fischen gemischten Ammoniaks; Seine Dämpfe machen mühsam und gefährlich diese Substanz ohne einen geeigneten Extraktor oder eine geeignete Kleidung.
Zusätzlich zu seinen jeweiligen Formeln wird es normalerweise als ASD in diese Verbindung abgekürzt. Dies kann jedoch zu Verwirrung mit anderen Aminen wie Trietanolamin, N (Etherh) führen3, oder das Tetraetilamonium, eine quaternäre Amina, Netz4+.
 Triethylamin -Skelett. Quelle: Mischungen [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]]
Triethylamin -Skelett. Quelle: Mischungen [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/]] Aus seinem Skelett (überlegenes Bild) kann gesagt werden, dass Triethylamin dem Ammoniak ziemlich ähnlich ist; Während der zweite drei Wasserstoffe hat, NH3, Der erste hat drei Ethylgruppen, n (CH2CH3)3. Seine Synthese beginnt mit der Behandlung von flüssigem Ammoniak mit Ethanol und tritt eine Alkylierung auf.
Das Netz3 Sie können ein hygroskopisches Salz mit HCL bilden: Triethilaminhydrochlorid, Netz3· HCl. Darüber hinaus nimmt er als homogener Katalysator an der Synthese von Estern und Amidas teil, sodass es ein notwendiges Lösungsmittel für organische Labors ist.
Zusammen mit anderen Reagenzien ermöglicht es auch die Oxidation von primären und sekundären Alkoholen auf Aldehyde bzw. Ketone. Wie Ammoniak ist eine Basis und kann daher durch Neutralisationsreaktionen organische Salze bilden.
[TOC]
Struktur von Triethylamin
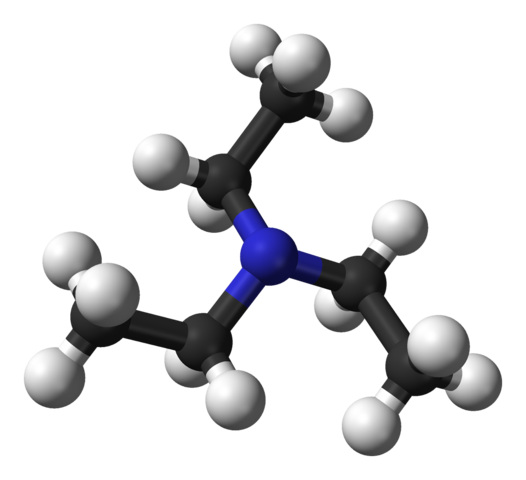 Struktur von Triethylamin. Quelle: Benjah-BMM27 [Public Domain].
Struktur von Triethylamin. Quelle: Benjah-BMM27 [Public Domain]. Das obere Bild zeigt die Struktur des Triethylamins mit einem Modell von Kugeln und Stäben. In der Mitte des Moleküls befindet sich das Stickstoffatom, das durch eine bläuliche Kugel dargestellt wird; Und mit ihm verbunden, die drei Ethylgruppen, wie kleine Zweige schwarzer und schwarzer Kugeln.
Obwohl sie nicht mit bloßem Auge sind, gibt es auf dem Stickstoffatom einige nicht gemeinsame Elektronen. Diese beiden Elektronen und die drei Gruppen -ch2CH3 Sie erleben elektronische Abstoßungen; Andererseits tragen sie dazu bei, das Dipolmoment des Moleküls zu definieren.
Kann Ihnen dienen: Cycloalcanos: Eigenschaften, Reaktionen, Verwendungen, BeispieleEin solches Dipolmoment ist jedoch niedriger als beispielsweise Diethylamin, Nhet2; Und es fehlt auch die Möglichkeit, Wasserstoffbrücken zu bilden.
Dies liegt daran.
Während es ein leichtes Dipolmoment gibt, können die Dispersion zwischen Ethylgruppen von Nettomolekülen nicht ausgeschlossen werden3 Nachbarn. Wenn dieser Effekt hinzugefügt wird, ist es gerechtfertigt, warum es, obwohl das Triethylamin flüchtig ist, dank seiner relativ großen Molekülmasse um 89 ° C kocht.
Eigenschaften
Aussehen
Farblose Flüssigkeit mit unangenehmem Geruch von Ammoniak und Fisch.
Molmasse
101,193 g/mol.
Siedepunkt
89ºC.
Schmelzpunkt
-115ºC. Beachten Sie, wie schwach die intermolekularen Kräfte, die die Triethylaminmoleküle in ihrem Feststoff vereinen.
Dichte
0,7255 g/ml.
Löslichkeit
Es ist relativ löslich in Wasser, 5,5 g/100 g bei 20 ° C. Unter 18,7 ºC ist es laut Pubchem sogar damit mischbar.
Zusätzlich zum "Zusammenkommen" mit Wasser ist es auch löslich in Aceton, Benzol, Ethanol, Ether und Paraffin.
Wasserdampfdichte
3.49 in Bezug auf Luft.
Dampfdruck
57,07 mmHg bei 25ºC.
Henry konstant
66 μmol/pa · kg.
Zündungspunkt
-15ºC.
Selbstdirektionstemperatur
312ºC.
Wärmekapazität
216,43 kJ/mol.
Verbrennungswärme
10.248 Kalk/g.
Verdampfungswärme
34,84 kJ/mol.
Oberflächenspannung
20,22 N/m A 25ºC.
Brechungsindex
1.400 bis 20ºC.
Schmiere
0,347 MPa · s bei 25ºC.
Basizitätskonstante
Trietilamin hat eine PKB in Höhe von 3,25.
Basizität
Die Basizität für dieses Amin kann durch die folgende chemische Gleichung ausgedrückt werden:
Kann Ihnen dienen: synthetische PolymereNetz3 + Ha nhet3+ + ZU-
Wo ist es eine schwache Säurespezies?. Das NHET -Paar3+ZU- Es bildet das, was zu einem tertiären Ammoniumsalz wird.
NHET -Konjugatsäure3+ Es ist stabiler als Ammonium, NH4+, weil die drei Ethylgruppen einen Teil ihrer elektronischen Dichte spenden, um die positive Belastung des Stickstoffatoms zu verringern; Daher ist Triethylamin grundlegender als Ammoniak (aber weniger grundlegend als OH-).
Anwendungen
 Durch Triethylamin katalysierte Reaktionen. Quelle: Tachymètre [Public Domain].
Durch Triethylamin katalysierte Reaktionen. Quelle: Tachymètre [Public Domain]. Basizität wird in diesem Fall die Nucleophilie von Triethylamin verwendet, um die Synthese von Ester und Amiden aus einem gemeinsamen Substrat zu katalysieren: ein Acylchlorid, RCOCl (überlegenes Bild).
Hier greift die freien Stickstoffelektronen die Carbonylgruppe an und bilden einen Vermittler. was nacheinander von einem Alkohol oder einem Amin angegriffen wird, um einen Ester bzw. Amida zu bilden.
In der ersten Zeile des Bildes wird der Mechanismus, der der Reaktion zur Erzeugung des Esters folgt, sichtbar gemacht, während die zweite Zeile dem Amida entspricht. Beachten Sie, dass bei beiden Reaktionen Triethylaminhydrochlorid auftritt, Netz3· HCl, aus dem der Katalysator gewonnen wird, um einen weiteren Zyklus zu starten.
Polymere
Die Nucleophilie von Triethylamin wird auch verwendet, um bestimmte Polymere hinzuzufügen, sie zu heilen und ihnen größere Massen zu geben. Zum Beispiel ist es Teil der Synthese von polycarbonierten Harzen, Polyurethanschaum und Epoxidharzen.
Chromatographie
Seine Fernamphifilität und Volatilität ermöglicht es, dass seine abgeleiteten Salze als Reagenzien in der Ionenaustauschchromatographie verwendet werden. Eine weitere implizite Verwendung von Triethylemin besteht darin, dass mehrere Salze tertiärer Amine davon erhalten werden können, wie Triethylamin -Bicarbonat, NHET3HCO3 (oder Teeb).
Kann Ihnen dienen: Kalorimetrie: Welche Studien und AnwendungenKommerzielle Produkte
Es wurde als Additiv bei der Formulierung von Zigaretten und Tabak, Lebensmittelkonservierungsstoffen, Böden, Aroma, Pestiziden, Farbstoffen usw. verwendet.
Risiken
Die Dämpfe von Triethylamin sind nicht nur unangenehm, sondern auch gefährlich, da sie Nase, Hals und Lungen reizen können, um Lungenödeme oder Bronchitis zu verursachen. Ebenso bleiben sie dichter und schwer als die Luft, sie bleiben auf dem Boden und bewegen sich auf mögliche Wärmequellen, um anschließend zu explodieren.
Die Behälter dieser Flüssigkeit müssen so weit vom Feuer entfernt sein, weil sie eine unmittelbar bevorstehende Explosionsgefahr darstellen.
Darüber hinaus Kontakt mit Spezies oder Reagenzien wie: alkalische Metalle, Tricloressigsäure, Nitrate, Salpetersäure (da sie Nitrosoamine, krebserzeugte Verbindungen bilden würde), starke Säuren, Peroxide und Permanganate.
Sie sollten weder Aluminium, Kupfer, Zink oder seine Legierungen berühren, da es die Fähigkeit hat, sie zu korrodieren.
In Bezug auf den physischen Kontakt kann dies zu Allergie- und Hautausschlägen führen. Zusätzlich zu den Lungen kann es die Leber und die Nieren beeinflussen. Und in Bezug auf den Augenkontakt verursacht er Reizungen, was sogar die Augen beschädigen könnte, wenn sie nicht in der Zeit behandelt oder gereinigt werden.
Verweise
- Morrison, r. T. und Boyd, r, n. (1987). Organische Chemie. 5. Ausgabe. Editorial Addison-Wesley Interamerikaner.
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Braten. (2011). Organische Chemie. Amine. (10. Ausgabe.). Wiley Plus.
- Wikipedia. (2019). Triethylamin. Abgerufen von: in.Wikipedia.Org
- Merck. (2019). Triethylamin. Erholt von: Sigmaaldrich.com
- Nationales Zentrum für Biotechnologie Information. (2019). Triethylamin. Pubchem -Datenbank. CID = 8471. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Toxicology Data Network. (S.F.). Triethylamin. Wiederhergestellt von: Toxnet.NLM.NIH.Regierung
- Das Gesundheitsministerium in New Jersey. (2010). Triethylamin. Erholt von: NJ.Regierung
- « 10 Kuriositäten über das Mittelalter, die Sie überraschen werden
- Isoamilico alkoholische Struktur, Eigenschaften, Verwendung und Risiken »

