Typtophaneigenschaften, Struktur, Funktionen, Vorteile
- 4550
- 562
- Ivan Pressler
Er Tryptophan (TRP, W) ist eine Aminosäure, die innerhalb der Gruppe essentieller Aminosäuren klassifiziert ist, da der menschliche Organismus sie nicht synthetisieren kann und sie durch die Ernährung erhalten muss.
Einige Lebensmittel wie Milch und deren Derivate, Fleisch, Eier und einige Getreide wie Quinoa und Soja enthalten wesentliche Aminosäuren und sind daher eine wichtige Quelle für Tryptophan.
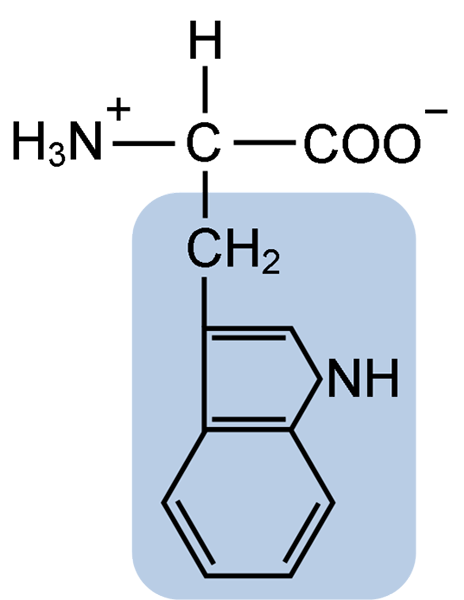
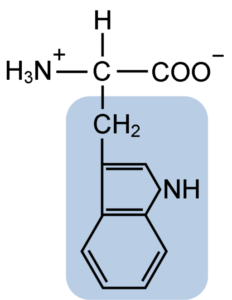 Chemische Struktur der Typtophan-Aminosäure (Quelle: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Chemische Struktur der Typtophan-Aminosäure (Quelle: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) In der Natur sind mehr als 300 verschiedene Aminosäuren bekannt und nur 22 bilden die monomeren Einheiten von Zellproteinen. Unter den letzteren sind 9 wesentliche Aminosäuren, einschließlich Tryptophan, aber die Wesentlichkeit jeder jeweils zwischen einer Spezies und einer anderen unterscheidet sich.
Der Tryptophan hat verschiedene Funktionen, unter denen ihre Beteiligung an der Proteinsynthese an der Synthese von Serotonin, einem leistungsstarken Vasokonstriktor und Neurotransmitter, von Melatonin und in der Synthese des Co -Begründers NAD ist.
Im Pflanzenreich ist Tryptophan ein grundlegender Vorläufer des Pflanzenhormons, der als Auxin (Indol-3-Essigsäure) bekannt ist. Es kann von einigen Bakterien wie zum Beispiel synthetisiert werden UND. coli Aus dem Corismato, das aus einigen glykolytischen Derivaten wie Phosphoenolpiruvat und Erythrosa-4-Phosphat hergestellt wird.
Sein Abbau bei Säugetieren erfolgt in der Leber, wo es für die Synthese von Acetyl-Coenzym A (Acetyl-CoA) verwendet wird, und aus diesem Grund wird es als Aminosäure-nennt es Glukogen, da sie in den Glukose-Bildungszyklus gelangen kann.
Verschiedene Studien wurden mit kontroversen Ergebnissen im Zusammenhang mit der Verwendung von Tryptophan als Nahrungsergänzungsmittel zur Behandlung einiger Pathologien wie Depressionen und einigen Schlafstörungen berichtet.
Es gibt einige Krankheiten im Zusammenhang mit angeborenen Defekten beim Aminosäurstoffstoffwechsel. Im Fall von Typtophan kann die Hartnup -Krankheit aufgrund von Tryptophan -2,3 -Monoxigenase ernannt werden, einer rezessiven erblichen Krankheit, die durch geistige Behinderung und Veränderungen des Pelagra -Hauttyps gekennzeichnet ist.
[TOC]
Eigenschaften
Zusammen mit Phenylalanin und Tyrosin findet sich Tryptophan in der Gruppe aromatischer und hydrophober Aminosäuren.
Tryptophan ist jedoch dadurch gekennzeichnet, dass sie eine leicht hydrophobe Aminosäure seit ihrer aromatischen Seitenkette ist, indem polare Gruppen diese Hydrophobizität abschwächen.
Für kombinierte Ringe haben sie eine starke Lichtabsorption im Spektrumbereich in der Nähe von Ultraviolett, und dieses Merkmal wird häufig für die Strukturanalyse von Proteinen verwendet.
Es absorbiert ultraviolettes Licht (zwischen 250 und 290 nm), und obwohl diese Aminosäure in der Struktur der meisten menschlichen Körperproteine nicht sehr reichlich vorhanden ist, ist ihr Vorhandensein ein wichtiger Beitrag für die Lichtabsorptionskapazität von Licht im Bereich der Region des 280 nm der meisten Proteine.
Die täglichen Anforderungen von Tryptophan unterscheiden sich mit dem Alter. Bei Säuglingen zwischen 4 und 6 Monaten beträgt die durchschnittliche Anforderung etwa 17 mg pro Kilogramm Gewicht pro Tag; Bei Kindern im Alter von 10 bis 12 Jahren beträgt es 3,3 mg pro Kilogramm Gewicht pro Tag und bei Erwachsenen 3,5 mg pro Kilogramm Gewicht pro Tag.
Tryptophan wird vom Darmweg absorbiert und ist gleichzeitig eine ketogene und glykogene Aminosäure.
Da es sich um einen Serotonin -Vorläufer, ein wichtiger Neurotransmitter, muss das Tryptophan das Zentralnervensystem (ZNS) erreichen und dafür die Bluthirnbarriere überqueren, für die es einen spezifischen aktiven Transportmechanismus gibt.
Kann Ihnen dienen: Biggy Agar: Foundation, Vorbereitung und VerwendungStruktur
Tryptophan hat eine molekulare Formel C11H12N2O2 und diese essentielle Aminosäure hat eine aromatische Seitenkette.
Wie alle Aminosäuren hat Tryptophan ein α -Kohlenstoffatom, das an eine Aminogruppe (NH2), ein Wasserstoffatom (H), eine Carboxylgruppe (COOH) und eine Seitenkette (R) gebunden ist.
Sein chemischer Name ist 2-Amino-3-Propionsäure, er hat eine molekulare Masse von 204,23 g/mol. Die Löslichkeit bei 20 ° C beträgt 1,06 g in 100 g Wasser und hat eine Dichte von 1,34 g/cm3.
Funktionen
Im menschlichen Wesen wird das Tryptophan für die Proteinsynthese verwendet und ist für die Serotoninbildung (5-Hydroxitriptamin) ein starker Vasokonstriktor unverzichtbar, der die glatte Muskelkontraktion (insbesondere im Dünndarm) und einen Neurotransmitter in der Lage ist, psychische Stimulation, Kombatdepression zu generieren, Kombatdepressdepressionen zu erzeugen, Kombatdepressdepressionen und Angst regulieren.
Tryptophan ist ein Vorläufer in der Synthese von Melatonin und hat daher Auswirkungen auf Schlaf- und Wachzyklen.
Die Aminosäure wird als Vorläufer auf eine der drei Arten für die Bildung des NAD-Cofaktors verwendet, eines sehr wichtigen Cofaktor.
Tryptophan und einige seiner Vorläufer werden zur Bildung eines Vegetationshormons namens Auxin (INDOL-3-aktive Säure) verwendet. Auxine sind Pflanzenhormone, die das Wachstum, die Entwicklung und viele andere physiologische Funktionen von Pflanzen regulieren.
Biosynthese
In den Organismen, die es synthetisieren können. Diese wiederum stammen aus einem Vermittler des Krebszyklus: Oxalacetat.
Phosphoenolpiruvat und Erythrous-4-phosphat werden zur Corismat-Synthese auf einem enzymatischen Weg verwendet. Phosphoenolpiruvat (PEP) ist ein Produkt der Glykolyse und Erythrous-4-Phosphat des Pentosephosphatwegs.
Wie ist die Corismat -Syntheseroute??
Der erste Schritt der Symptome von Corismato ist die Vereinigung des PEP mit dem Erythrosa-4-Phosphat, das 2-ZO-3-Disoxxi-D-Anabino-Heptulosonato-7-Phosphat (DAHP) (DAHP) bildet (DAHP).
Diese Reaktion wird durch das Enzym 2-ZO-3-Dexxi-d-Anabino-Heptulosonato-7-Phosphat-Synthase (DAHP-Syntasa) katalysiert, das durch das Corismat inhibiert wird.
Die zweite Reaktion impliziert die Ziklierung des DAHP durch das Synthase -Dehydrochinat, ein Enzym, das den Co -Faktor -NAD benötigt, der während dieser Reaktion verringert wird; Infolgedessen tritt 5-dishydroquinate auf.
Der dritte Schritt dieser Route impliziert die Eliminierung eines Wassermoleküls von 5-Dehydroquinat, die durch das Enzym-Dehydratase-Dehydrochinat katalysierte Reaktion, deren Endprodukt dem 5-Dishydro Shikimato entspricht.
Die Ketogruppe dieses Moleküls wird auf eine Hydroxylgruppe reduziert, und infolgedessen wird Shikimato gebildet. Das Enzym, das diese Reaktion katalysiert.
Der fünfte Schritt der Route impliziert die Bildung von 5-phosphat-Shikimate und den Verbrauch eines ATP-Moleküls durch ein als Kinase Shikimato bekanntes Enzym, das für die Phosphorylierung von Shikimate in Position 5 verantwortlich ist.
Anschließend von 5-phosphat-Shikimate und durch die Wirkung der 3-Enlappiruvil-Shikimato-5-Phosphat-Synthase wird 3-enlappiruvil Shikimato 5-phosphat erzeugt. Das oben genannte Enzym fördert die Verschiebung der Phosphorylgruppe eines zweiten PEP-Moleküls durch die Hydroxylgruppe von Kohlenstoff in Position 5 von 5-Phosphat-Shikimate.
Es kann Ihnen dienen: Warum ist es wichtig, sich um die biologische Vielfalt zu kümmern?Die siebte und letzte Reaktion wird durch den Synthase-Corismus katalysiert, der Phosphat aus dem 3-Enlappat-Shikimate 5-Phosphat beseitigt und es korismiert macht.
Im Pilz N. Crassa, Ein einzelner multifunktionaler enzymatischer Komplex katalysiert fünf der sieben Reaktionen dieses Weges und dieser Komplex werden drei weitere Enzyme hinzugefügt, die Tryptophan erzeugen.
Tryptophan -Synthese in Bakterien
In UND. coli, Tryptophan Corism Transformation umfasst eine fünf zusätzliche enzymatische Route:
Erstens wandelt das Antranilat -Synthase -Enzym das Corismat in Antranilat um. In dieser Reaktion nimmt ein Glutaminmolekül teil, das von der Amino -Gruppe gespendet wird, die an den Indol -Ring des Tryptophans bindet und Glutamat wird.
Der zweite Schritt wird durch das Phosphotribosyltransferase -Antranilat katalysiert. In dieser Reaktion wird ein Pyrophosphatmolekül des 5-phosphorribosyl-1-pyrophosphat (PRPP) (PRPP) (PRPP) reich an Energie bewegt, und das N- (5'-Phosphorribosyl) wird gebildet.
Die dritte Reaktion dieser Tryptophan-Syntheseroute impliziert die Teilnahme des Phosphorribosylisomerase-Enzyms. Hier das N- (5'-Phorribosyl) -Santhranylat.
Später wird das Indol-3-Glycerin-Phosphat in einer Reaktion gebildet, die durch das Indol-3-Glycerol-Sympathie-Synthase katalysiert wird, wobei ein CO2 und ein H2O.
Die letzte Reaktion dieser Route bildet Tryptophan, wenn der Tryptophan -Synthase -Katalyz.
Degradierung
Bei Säugetieren wird Tryptophan auf einer Route, die zwölf enzymatische Schritte umfasst, in der Leber zu Acetyl-CoA abgebaut.
Die Reihenfolge des Abbaus bis zur α-Cetoadipato:
Typtophan → N-Quinurenin-Formil → Quinurenin → 3-Hydroxi Quinurenin → 3-Hydroxy-Antranilat → ε-semialdehyd 2-amino-3-muconcycix → ε-Semialdehido α-Amino Muconcix Amouz.
Die Enzyme, die diese Reaktionen katalysieren, sind:
Typtophan 2-3-Dioxigenase, Formamidase Quinurenin, NADPH-abhängige Monooxigenase NADPH-abhängige.
Sobald α-Cethoadipat erzeugt ist, bildet die oxidative Decarboxylierung Gluteral-CoA. Dies durch ß-Oxidation, Glutaconyl-CoA-Form, die ein Bicarbonat-Kohlenstoffatom (HCO3-) verliert, gewinnt ein Wassermolekül und endet als Crotonil-CoA.
Crotonil-CoA, auch für ß-Oxidation, liefert Acetyl-CoA. SAD ACetyl-CoA kann auf verschiedene Arten folgen, unter denen die Glukoneogenese zum Glukose- und den Krebszyklus bildet, um nach Bedarf ATP zu bilden.
Dieses Molekül kann jedoch auch auf die Bildung von Ketonkörpern gerichtet werden, die schließlich als Energiequelle verwendet werden können.
Lebensmittel, die reich an Tryptophan sind
Rotes Fleisch im Allgemeinen, Hühnchen und Fisch (insbesondere blaue Fische wie Lachs und Thunfisch) sind besonders reich an Tryptophan. Milch und seine Derivate, Eier, insbesondere das Eigelb, sind auch Lebensmittel mit viel Tryptophan -Inhalt.
Andere Lebensmittel, die als natürliche Quelle dieser Aminosäure dienen, sind:
- Nüsse wie Nüsse, Mandeln, Pistazien und Anakardos unter anderem.
- Reiszerealien.
- Trockene Körner wie Bohnen, Linsen, Kichererbsen, Sojabohnen, Quinoa usw.
- Bierhefe und frische Bohnen, Bananen und Bananen, Ananas oder Ananá, Avocado, Pflaumen, Brunnenkresse, Brokkoli, Spinat und Schokolade.
Es kann Ihnen dienen: U -Boot -Hai: Geschichte, Realität oder Fiktion?Vorteile Ihrer Aufnahme
Der Verbrauch von Typtophan ist absolut notwendig, um all jene Proteine zu synthetisieren, die ihn in seine Struktur einbeziehen, und durch seine unterschiedlichen Funktionen ermöglicht es die Regulierung von Stimmungs-, Schlaf- und Mahnzyklen sowie eine Vielzahl von biochemischen Prozessen, an denen NAD teilnimmt.
Zusätzlich zu den bekannten Auswirkungen auf die Stimmung interveniert Serotonin (Tryptophan abgeleitet) in mehreren kognitiven Funktionen im Zusammenhang mit Lernen und Gedächtnis, die daher auch mit Tryptophan zusammenhängen.
Es gibt Daten, die die Beziehung zwischen Stimmung, Serotonin und gastrointestinaler Cerebral-Achse als System bidirektionaler Einflüsse zwischen emotionalen und kognitiven Zentren des Gehirns und der peripheren Funktion des Verdauungstrakts zeigen.
Verwenden Sie als Nahrungsergänzungsmittel zur Behandlung einiger Störungen, insbesondere derjenigen, die mit dem Zentralnervensystem zusammenhängen seine orale Verwaltung.
Trotz dieser Kontroversen wurde seine Verwendung als Ergänzung postuliert:
- Schmerzbehandlung
- Schlafstörungen
- Depressionsbehandlung
- Mania -Behandlung
- Appetitreduzierung
Mangelerkrankungen
Die zentrale Eliminierung oder das Fehlen von Tryptophan wird von Depressionen, Aufmerksamkeitsfehlern, Verringerung des Gedächtnisses, Schlaf- und Angststörungen begleitet.
Bei depressiven Patienten und mit Selbstmordtrends wurden Veränderungen der Blutkonzentration und der Cerebrospinalflüssigkeit festgestellt. Darüber hinaus weisen einige Patienten mit nervöser Magersucht niedrige Serumspiegel an Tryptophan auf.
Einige polyurische Patienten, die Vitamin B6 und Zink verlieren, haben häufig Phobien und Angstzustände und verbessern sich mit Nahrungsergänzungsmitteln, die reich an Triptophan sind.
Das Karzinoid -Syndrom ist durch das Vorhandensein von Dünndarmtumoren gekennzeichnet, die Durchfall, Gefäßkrankheiten und Bronchokonstriktion verursachen und mit dem Niacin- und Tribophandefizit verbunden sind
Pelagra ist eine pathologische Erkrankung, die von Durchfall, Demenz, Dermatitis begleitet wird und den Tod verursachen kann. Dies wird auch mit Niacin- und Tryptophan -Nahrungsergänzungsmitteln behandelt.
Die Hartnup -Krankheit muss unter einigen Dingen mit einem Defekt des Stoffwechsels mehrerer Aminosäuren, einschließlich Tryptophan.
Im Fall des Defizits des Typtophan -2,3-Monoxigenase-Enzyms ist dies eine rezessive erbliche Krankheit, die durch geistige Behinderung und Hautveränderungen vom Typ Haut gekennzeichnet ist.
Verweise
- Halvorsen, k., & Halvorsen, s. (1963). Hartnup -Krankheit. Pädiatrie, 31(1), 29-38.
- Haube, s. D., Bell, c. J., Argyropoulos, s. V., & Nutt, D. J. (2016). Don's Panik. Ein Leitfaden zur Tryptophan-Depletion mit störungsspezifischer Angstprovokation. Journal of Psychopharmacology, 30(11), 1137-140.
- Jenkins, t. ZU., Nguyen, j. C., Polglaze, k. UND., & Bertrand, p. P. (2016). Einfluss von Tryptophan und Serotonin auf Stimmung und Wahrnehmung mit einer möglichen Rolle der Darmboinachse. Nährstoffe, 8(1), 56.
- Kaye, w. H., Barbarich, n. C., Putnam, k., Gendall, k. ZU., Fernstrom, J., Fernstrom, m.,… & Kishore, a. (2003). Anxiolytische Wirkungen einer akuten Tryptophaner -Depletion bei Anorexia nervosa. Internationales Journal für Essstörungen, 33(3), 257-267.
- Murray, r. K., Granner, d. K., Mayes, p., & Rodwell, V. (2009). Harpers illustrierte Biochemie. 28 (P. 588). New York: McGraw-Hill.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehninger Prinzipien der Biochemie. Macmillan.
- « Prolineigenschaften, Struktur, Funktionen, Lebensmittel
- Katalaps Ursachen, Symptome und Behandlung »

