Arsen -Trioxid (AS2O3)
- 2654
- 834
- Rieke Scheer
Er Arsen -Trioxid Es ist eine anorganische Verbindung, deren chemische Formel so ist2ENTWEDER3. Arsen in seinem metallischen Zustand wird schnell in dieses Oxid umgewandelt, ein sehr giftiges Gift, das akute und chronische Manifestationen haben kann.
Arsen- und Sauerstoffelemente von Block P mit einem relativ geringen Elektronegativitätsunterschied wird das ACE erwartet2ENTWEDER3 aus kovalenter Natur bestehen; Das heißt, dass die AS-O-Bindungen in ihrem Feststoff dominieren, was elektrostatische Wechselwirkungen zwischen den Asionen3+ ICH2-.
Akute Vergiftung mit Arsen -Trioxid wird durch Aufnahme oder Inhalation erzeugt, was die wichtigsten Manifestationen davon ist: starke Magen -Darm -Störungen, Krämpfe, Kreislaufkollaps und Lungenödeme.
Trotz seiner Toxizität wurde es industriell eingesetzt. Zum Beispiel bei der Erhaltung von Holz, bei der Ausarbeitung von Pigmenten, Halbleitern usw. Ebenso wurde es früher bei der Behandlung zahlreicher Krankheiten eingesetzt.
Das Arsen -Trioxid ist eine amphotere Verbindung, die in Säuren und verdünnte Alkalien löslich ist, in organischen Lösungsmitteln unlöslich und in Wasser relativ löslich. Es wird als festes (überlegenes Bild) mit zwei kristallinen Formen dargestellt: kubisch und monoklinisch.
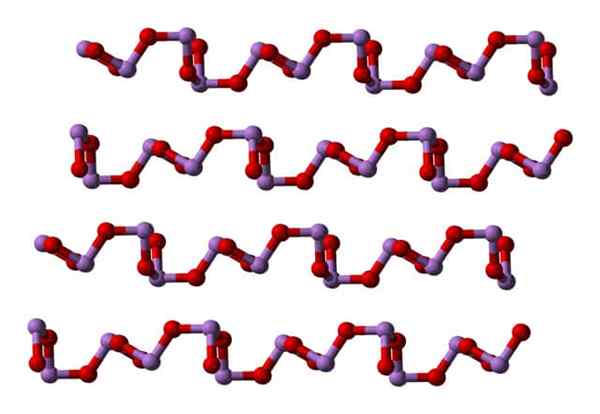
Arsen -Trioxidstruktur
Claudetita
Bei Raumtemperatur das Ass2ENTWEDER3 Kristallisiert in zwei monoklinen Polymorphen, beide im Claudetita -Mineral gefunden. In ihnen gibt es trigonale Pyramideneinheiten ASO3, die durch ihre Sauerstoffatome binden, um den elektronischen Mangel der Einheit allein auszugleichen.
In einem Polymorph die ASO -Einheiten3 Sie sind verknüpfte Formreihen (Claudetita I), und in der anderen sind sie verbunden, als ob sie ein Netzwerk (Claudetita II) gewebten:
Kann Ihnen dienen: agglomerante Materialien Claudetita Polymorfo Struktur i. Quelle: Ben Mills [Public Domain].
Claudetita Polymorfo Struktur i. Quelle: Ben Mills [Public Domain].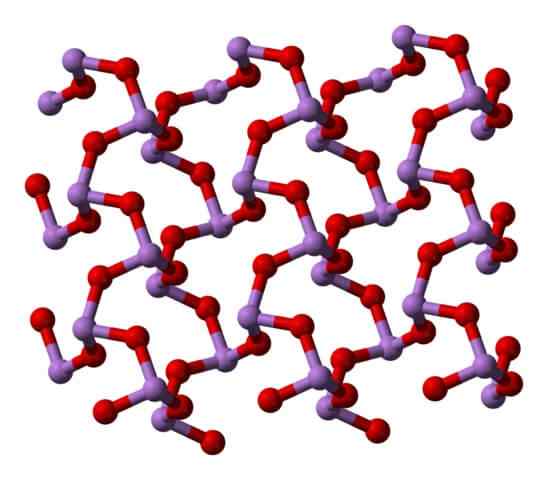 Claudetita Polymorfo Struktur II. Quelle: Ben Mills [Public Domain].
Claudetita Polymorfo Struktur II. Quelle: Ben Mills [Public Domain].
Flüssig und gasförmig
Wenn all diese Strukturen, die monokline Kristalle definieren, erhitzt werden, sind die Schwingungen so, dass mehrere AS-O-Verbindungen gebrochen werden und ein kleineres Molekül herrscht:4ENTWEDER6. Im unteren Bild wird seine Struktur gezeigt.
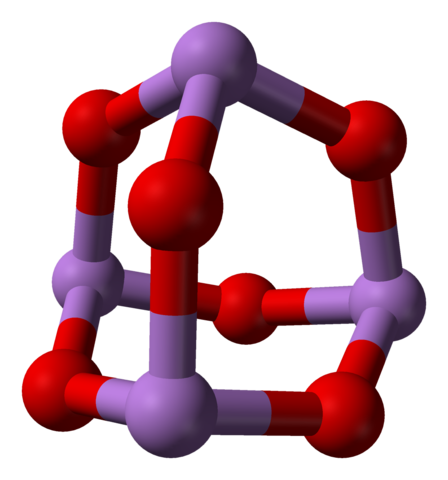 AS4O6 -Molekül. Quelle: Ben Mills [Public Domain]
AS4O6 -Molekül. Quelle: Ben Mills [Public Domain] Es könnte gesagt werden, dass es aus einem Tag von AS besteht2ENTWEDER3. Seine Stabilität ist so, dass sie 800 ° C in einer Gasphase unterstützt; Aber über dieser Temperatur ist es als Moleküle fragmentiert2ENTWEDER3.
Arsenolit
Das Gleiche wie4ENTWEDER6 kann miteinander interagieren, um in einem kubischen Feststoff zu kristallisieren, dessen Struktur im Arsenolitenmineral vorkommt.
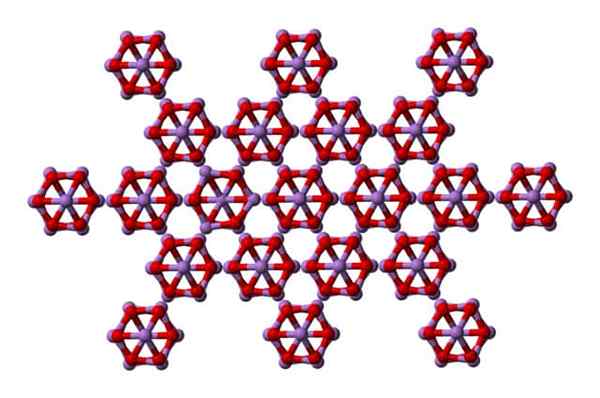 AS4O6 -Moleküle im Arsenoliten Feststoff. Quelle: Ben Mills [Public Domain]
AS4O6 -Moleküle im Arsenoliten Feststoff. Quelle: Ben Mills [Public Domain] Beachten Sie, dass im Bild die Struktur aus einer höheren Ebene gezeigt wird. Im Vergleich zu Claudetita ist sein struktureller Unterschied zu Arsenolit offensichtlich. Hier sind sie diskrete Moleküle4ENTWEDER6 dass Einheiten von Van der Waals Forces aufrechterhalten werden.
Eigenschaften
Namen austauschen
-Arsenolit
-Arsodent
-Trisenox
-Claudetita
Molekulargewicht
197.84 g/mol.
Aussehen
-Weiße Kubikkristalle (Arsenolit).
-Monokline farblose Kristalle (Claudetita).
-Weißer oder transparenter fester, glaser, amorpher Klumpen oder kristalliner Staub.
Geruch
Toilette.
Geschmack
Geschmacklos.
Siedepunkt
460 ºC.
Schmelzpunkt
-313 ºC (Claudetita).
-274 ºC (Arsenolit).
Zündungspunkt
485 º C (Sublima).
Wasserlöslichkeit
17 g/l a 18 ºC (20 g/l a 25 ºC).
Löslichkeit
Säurelöslich (insbesondere in Salzsäure) und Alkalien. Praktisch unlöslich in Chloroform und Äther.
Kann Ihnen dienen: ZentrifugationDichte
-3,85 g/cm3 (Kubikkristalle);
-4,15 g/cm3 (Rhombische Kristalle).
Dampfdruck
2,47 · 10-4 mmHg bei 25 ° C.
Zersetzung
Es ist kein Kraftstoff, aber aufgrund der Erwärmung kann es einen giftigen Rauch verursachen, der Arsina beinhalten kann.
Korrosivität
In Gegenwart von Feuchtigkeit kann es für Metalle korrosiv sein.
Verdampfungswärme
77 kJ/mol.
Dissoziationskonstante (KA)
1,1 · 10-4 bei 25 ºC.
Brechungsindex
-1.755 (Arsenolit)
-1.92-2.01 (Claudetita).
Reaktivität
-Arsen -Trioxid ist eine amphotere Verbindung, aber es funktioniert vorzugsweise als Säure.
-Es kann mit Salzsäure oder fluorhorischer Säure reagieren und Arsen -Triflourid oder Arsen -Triflourur bilden.
-Es reagiert auch mit starken Oxidationsmitteln wie Salpetersäure, was Arsensäure und Lachgas verursacht.
-Arsen -Trioxid kann mit Salpetersäure reagieren und in Abhängigkeit von den Reaktionsbedingungen ein Arsen- oder Arsenelement erzeugen.
As2ENTWEDER3 + 6 Zn +12 HNO3 => 2 Asche3 + 6 Zn (nein3)2 + 3 h2ENTWEDER.
Diese Reaktion diente als Grundlage für die Schaffung des Marsh -Tests, der zum Nachweis der Arsenvergiftung verwendet wurde.
Nomenklatur
Bei2ENTWEDER3 Es kann nach den folgenden Nomenklaten ernannt werden, wobei es weiß, dass Arsen mit Valencia +3 zusammenarbeitet:
-Arseniosooxid (traditionelle Nomenklatur).
-Arsenoxid (III) (Stock Nomenklatur).
-Diarsen -Trioxid (systematische Nomenklatur).
Anwendungen
Industrielle
-Es wird bei der Herstellung von Glas verwendet, insbesondere als Verblassungsmittel. Es wird auch bei der Ausarbeitung von Keramik, elektronischen Produkten und Feuerwerkskörpern verwendet.
-Es wird als kleinere Komponente zu Kupferbasis -Legierungen hinzugefügt, um die Korrosionsbeständigkeit von Legierungsmetallen zu erhöhen.
-Das as2ENTWEDER3 Es ist das Ausgangsmaterial für die Herstellung von Elementararsen, die Verbesserung der Elektroverbindungen und zur Ausarbeitung von Arsenuros -Halbleitern
Es kann Ihnen dienen: Kernchemie: Geschichte, Studienbereich, Bereiche, Anwendungen-Das as2ENTWEDER3, Neben Kupferarseniato werden sie als Holzkonservierungsmittel verwendet. Es wurde in Kombination mit Kupferacetat zur Ausarbeitung des grünen Pigments von Paris verwendet, das bei der Ausarbeitung von Gemälden und Raten verwendet wird.
Ärzte
-Arsen -Trioxid ist eine Verbindung, die seit Jahrhunderten bei der Behandlung zahlreicher Krankheiten verwendet wird. Es wurde als Tonikum bei der Behandlung von Ernährungsstörungen, Neuralgie, Rheuma, Arthritis, Asthma, Korea, Malaria, Syphilis und Tuberkulose verwendet.
-Ebenso wurde es bei der lokalen Behandlung von Hautkrankheiten verwendet, die verwendet werden, um einige oberflächliche Epithelome zu zerstören.
-Fowlers Lösung wurde bei der Behandlung von Hautkrankheiten und Leukämie eingesetzt. Die Verwendung dieses Arzneimittels wird eingestellt.
-In den 1970er Jahren entwickelte der chinesische Forscher Zhang Tingdong eine Untersuchung über die Verwendung von Arsen -Trioxid bei der Behandlung von akuter promielozytischer Leukämie (APL). Was zur Produktion des Trisenox -Arzneimittels führte, das von der Vereinigten Staaten FDA zugelassen wurde.
-Trisenox wurde bei PLA -Patienten verwendet, die nicht auf die Behandlung von „erster Linie“ ansprechen, bestehend aus allen Trans -Säure -Säure (ATTRA). Es wurde gezeigt, dass Arsen -Trioxid Krebszellen dazu induziert, Apoptose zu leiden.
-Trisenox wird als zytostatisch bei der Behandlung des refraktären priviselozytischen Subtyps (M) verwendet3) von App.
Verweise
- Arsen -Trioxid. Der Sevier. Abgerufen von: Scientedirect.com
- Arsen (III) Oxid. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- « Anthraceno Was ist Struktur, Eigenschaften, verwendet
- Dámaso Alonso Biographie, Stil und Arbeiten »

