Schwefeltrioxid (SO3) Struktur, Eigenschaften, Risiken, verwendet
- 1144
- 213
- Joe Hartwig
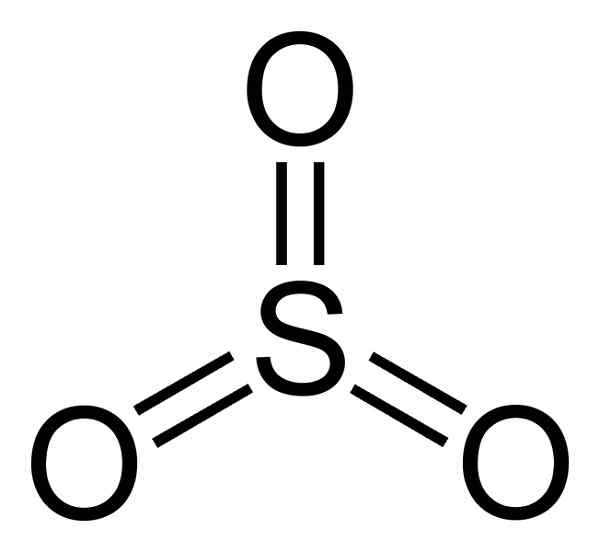
Er Schwefeltrioxid Es ist eine anorganische Verbindung, die durch die Vereinigung eines Schwefelatoms und 3 Sauerstoffatome (O) gebildet wird. Seine molekulare Formel ist so3. Bei Raumtemperatur die so3 Es ist eine Flüssigkeit, die Gase in der Luft abgibt.
Die Struktur des SO3 Gasförmig ist flach und symmetrisch. Der Drei -Sauerstoff befindet sich genauso rund um den Schwefel. Das so3 Reagiert heftig mit Wasser. Die Reaktion ist exotherm, was bedeutet, dass Wärme erzeugt wird, mit anderen Worten, viel erhitzt wird.
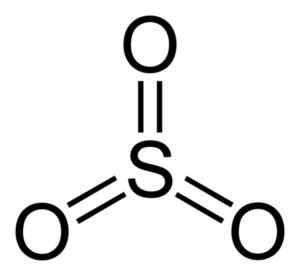 Schwefelmolekül so3. Autor: Benjah-BMM27. Quelle: Wikimedia Commons.
Schwefelmolekül so3. Autor: Benjah-BMM27. Quelle: Wikimedia Commons. Wenn das so3 Flüssigkühl. Das stabilste ist das Alpha in Form von Schichten zusammen miteinander, die ein Netzwerk bilden.
Gasförmiger Schwefeltrioxid wird verwendet, um Rauchschwefelsäure zuzubereiten, das auch aufgrund seiner Öl- oder öligen Substanzähnlichkeit als Öl bezeichnet wird. Eine weitere wichtige Anwendungen ist die Sulfonierung organischer Verbindungen, dh die Zugabe von Gruppen -So3- zu diesen. Somit können unter anderem nützliche Chemikalien hergestellt werden wie Reinigungsmittel, Farbstoffe, Pestizide.
Das so3 Es ist sehr gefährlich, es kann schwerwiegende Verbrennungen, Augen und Hautschäden verursachen. Es sollte auch nicht eingeatmet oder aufgenommen werden, weil es durch innere Verbrennungen, im Mund, in der Speiseröhre, im Magen usw. zum Tod führen kann.
Aus diesen Gründen muss es mit großer Vorsicht manipuliert werden. Sie sollten niemals Wasser oder brennbare Materialien wie Holz, Papier, Stoffe usw. kontaktieren., Nun, Feuer kann produziert werden. Es sollte auch aufgrund der Explosionsgefahr auch verworfen werden oder Abwasserkanäle.
Das so3 Gasous, die in industriellen Prozessen erzeugt wurden.
[TOC]
Struktur
Das Schwefel -Trioxidmolekül so3 Im gasförmigen Zustand hat es eine flache dreieckige Struktur.
Dies bedeutet, dass sowohl Schwefel als auch drei Sauerstoff in derselben Ebene gefunden werden. Darüber hinaus ist die Verteilung von Sauerstoff und allen Elektronen symmetrisch.
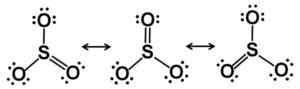 Lewis Resonance Starcutures. Elektronen sind in der SO gerecht verteilt3. Autor: Marilú Stea.
Lewis Resonance Starcutures. Elektronen sind in der SO gerecht verteilt3. Autor: Marilú Stea. In Festkörper sind drei Arten von SO -Struktur bekannt3: Alfa (α-SO3), Beta (β-SO3) und Gamma (γ-SO3).
Die Gamma-Form γ-SO3 Enthält zyklische Trimmer, dh drei Einheiten von SO3 zusammen ein zyklisches oder ringgeschnittenes Molekül bilden.
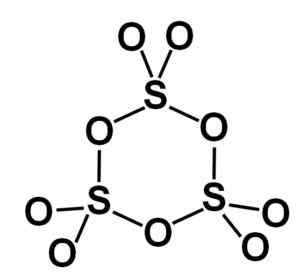 Ringmolekül des Gammas vom festen Schwefeltrioxidtyp. Autor: Marilú Stea.
Ringmolekül des Gammas vom festen Schwefeltrioxidtyp. Autor: Marilú Stea. Die Beta-β-SO-Phase3 Es hat unendliche helikale Ketten der Zusammensetzung Tetraeder so4 miteinander vereint.
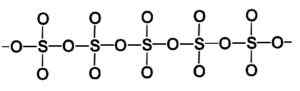 Struktur eines festen Schwefeltrioxid -Beta -Typs. Autor: Marilú Stea.
Struktur eines festen Schwefeltrioxid -Beta -Typs. Autor: Marilú Stea. Der stabilste Weg ist Alpha α-SO3, Ähnlich wie die Beta, aber mit einer Schichtstruktur, wobei die United -Ketten ein Netzwerk bilden.
Nomenklatur
-Schwefeltrioxid
-Schwefelanhydrid
-Schwefeloxid
-SW3 Gamma, γ-SO3
-SW3 Beta, β-SO3
-SW3 Alfa, α-SO3
Physikalische Eigenschaften
Körperlicher Status
Bei Raumtemperatur (ca. 25 ° C) und atmosphärischem Druck die SO3 Es ist eine farblose Flüssigkeit, die Dämpfe in der Luft ausgibt.
Wenn das so3 Die Flüssigkeit ist rein bei 25 ° C eine Mischung aus so3 monomer (ein einzelnes Molekül) und Trimer (3 gebundene Moleküle) der Formel s3ENTWEDER9, auch so genannt3 Gamma γ-SO3.
Kann Ihnen dienen: Rankine Scale: Was ist, Conversions, BeispieleBeim Absenken der Temperatur, wenn die so3 Es ist rein, wenn es 16,86 ºC erreicht, es verfestigt oder friert γ-SO ein3, Auch "so Eis so genannt3".
Wenn es kleine Mengen an Feuchtigkeit (sogar extrem kleine Spuren oder Mengen) enthält3 Polymerisiert das Beta-β-SO3 das bildet Kristalle mit einer seidigen Helligkeit.
Dann werden mehr Gewerkschaften gebildet, indem die α-SO-Struktur erzeugt wird3, Das ist ein kristalliner Feststoff in Form von Nadeln, die Asbest oder Asbest ähneln.
Wenn das Alpha und die Beta -Schmelze Gamma erzeugen.
Molekulargewicht
80.07 g/mol
Schmelzpunkt
SW3 Gamma = 16,86 ºC
Dreifacher Punkt
Es ist die Temperatur, bei der die drei physikalischen Zustände vorhanden sind: fest, flüssig und gasförmig. In der Alpha -Form liegt der dreifache Punkt bei 62,2 ºC und in der Beta liegt es bei 32,5 ° C.
Durch Erhitzen der Alpha -Form hat dies eine größere Tendenz zu Sublimisierung als zu schmelzen. Sublimimar bedeutet, sich direkt vom Festkörper in die Soda zu bewegen, ohne den flüssigen Zustand zu durchlaufen.
Siedepunkt
Alle Formen von SO3 Kochen Sie bei 44,8 ºC.
Dichte
Das so3 Flüssigkeit (Gamma) hat eine Dichte von 1.9225 g/cm3 bei 20 ºC.
Das so3 Gasous hat eine Dichte von 2,76 relativ zur Luft (Luft = 1), was darauf hinweist, dass sie schwerer als die Luft ist.
Dampfdruck
SW3 Alfa = 73 mm Hg bei 25 ºC
SW3 Beta = 344 mm Hg bei 25 ° C
SW3 Gamma = 433 mm Hg bei 25 ºC
Dies bedeutet, dass die Gamma -Form leichter verdampft als die Beta und das, was das Alpha.
Stabilität
Die Alpha -Form ist die stabilste Struktur, die anderen sind metastabil, das heißt, sie sind weniger stabil.
Chemische Eigenschaften
Das so3 reagiert energisch mit Wasser, um Schwefelsäure H zu ergeben2SW4. Bei der Reaktion gibt es sehr Wärme, so dass der Wasserdampf schnell von der Mischung abgelöst wird.
Ausgesetzt werden, um die SO zu lüften3 Feuchtigkeit schnell absorbieren und dichte Dämpfe emittieren.
Es ist ein sehr starkes Dehydrationsmittel, dies bedeutet, dass es Wasser leicht aus anderen Materialien beseitigt.
Der Schwefel des SO3 Es hat eine Affinität für freie Elektronen (dh Elektronen, die sich nicht in einem Zusammenhang zwischen zwei Atomen befinden), daher bildet es Komplexe mit Verbindungen, die sie besitzen, wie Pyridin, Trimethylamin oder Dioxan.
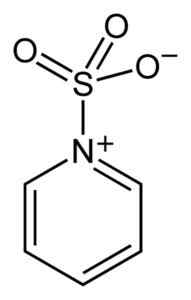 Komplex zwischen Schwefeltrioxid und Pyridin. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons.
Komplex zwischen Schwefeltrioxid und Pyridin. Benjah-BMM27 [Public Domain]. Quelle: Wikimedia Commons. Durch die Bildung von Komplexen nimmt Schwefel die Elektronen der anderen Verbindung „geliehen“, um ihr Fehlen dieser zu erfüllen. Schwefeltrioxid ist in diesen Komplexen noch erhältlich, die in chemischen Reaktionen verwendet werden, um dies zu liefern3.
Es handelt3- Zu den Molekülen.
Es reagiert leicht mit den Oxiden vieler Metalle, um Sulfate dieser Metalle zu ergeben.
Es ist ätzend gegenüber Metallen, Tier und Pflanzengeweben.
Das so3 Aus mehreren Gründen ist es ein schwieriges Material zu handhaben: (1) sein Siedepunkt ist relativ niedrig, (2) neigt dazu, bei Temperaturen von weniger als 30 ° C feste Polymere zu bilden, und (3) hat eine hohe Reaktivität gegenüber fast allen organischen Substanzen Und das Wasser.
Kann Ihnen dienen: amorphe Feststoffe: Struktur, Eigenschaften, BeispieleEs kann explosionsartig polymerisieren, wenn es keinen Stabilisator enthält und es Feuchtigkeit vorhanden ist. Als Stabilisatoren werden Dimethylsulfat oder Boroxid verwendet.
Erhalten
Es wird durch die Reaktion bei 400 ° C zwischen dem Schwefeldioxid erhalten2 und molekularer Sauerstoff oder2. Die Reaktion ist jedoch sehr langsam und Katalysatoren sind erforderlich, um die Geschwindigkeit davon zu erhöhen.
2 Also2 + ENTWEDER2 ⇔ 2 so3
Unter den Verbindungen, die diese Reaktion beschleunigen2ENTWEDER5, Eisenoxid2ENTWEDER3 und Stickoxid.
Anwendungen
In der Ölvorbereitung
Eine ihrer Hauptanwendungen besteht in der Herstellung von Öl- oder Rauchschwefelsäure, die genannt werden. Um es zu erhalten, wird das SO absorbiert3 In konzentrierter Schwefelsäure H2SW4.
 Pu -sulfurisches Oleum oder Rauchen. Sie können sehen, wie der weiße Rauch aus der Flasche kommt. W. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons.
Pu -sulfurisches Oleum oder Rauchen. Sie können sehen, wie der weiße Rauch aus der Flasche kommt. W. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons. Dies geschieht in speziellen Edelstahltürmen, in denen konzentrierte Schwefelsäure (was flüssig ist)3 Gasous geht auf.
Flüssigkeit und Gas kommen in Kontakt und verbinden sich und bilden das Oleum, das eine ölige Flüssigkeit ist. Dies hat eine Mischung aus H2SW4 Und so3, aber es hat auch Disulfursäuremoleküle H2S2ENTWEDER7 und Trisulfuric h2S3ENTWEDER10.
Bei chemischen Sulfonierungsreaktionen
Die Sulfonation ist ein wesentliches Verfahren in großtastenden industriellen Anwendungen für die Herstellung von Reinigungsmitteln, Tensiden, Farbstoffen, Pestiziden und Pharmazeutika.
Das so3 Es dient unter vielen anderen Verbindungen als sulfonantes Mittel zur Herstellung von Schwefelölen und Alkyl-angal-sulfonierten Reinigungsmitteln. Unten ist die Sulfonierungsreaktion einer aromatischen Verbindung:
Arh + so3 → Arso3H
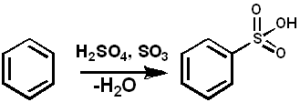 Benzolsulfonierung mit so3. Pedro8410 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons.
Benzolsulfonierung mit so3. Pedro8410 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikimedia Commons. Bei Sulfonierungsreaktionen können Oleum oder so verwendet werden3 in Form seiner Komplexe mit Pyridin oder Trimethylamin unter anderem.
In der Metallextraktion
Gas s3 Es wurde bei der Behandlung von Mineralien eingesetzt. Einfache Metalloxide können bei der Behandlung mit so viel löslichere Sulfate werden3 bei relativ niedrigen Temperaturen.
Schwefelmineralien wie Pyrit (Eisensulfid), Traktat3 Ermöglicht diese Metalle leicht und zu niedrigen Kosten.
Eisen, Nickel und Kupfersulfide reagieren mit so Gas3 Selbst bei Raumtemperatur bilden die jeweiligen Sulfate, die sehr löslich sind und anderen Prozessen ausgesetzt werden können, um reines Metall zu erhalten.
In mehreren Verwendungen
Das so3 Es dient zur Herstellung von Chlorosulfursäure, auch Chlorosulfonsäure HSO genannt3Cl.
Schwefeltrioxid ist ein sehr starkes Oxidationsmittel und wird in der explosiven Herstellung verwendet.
Risiken
Für die Gesundheit
Das so3 Es ist eine hochgiftige Verbindung durch alle Wege, dh Inhalation, Aufnahme und Hautkontakt.
Irrita und Korrodes Schleimhäute. Verursacht Haut und Augen. Seine Dämpfe sind sehr giftig, wenn sie eingeatmet werden. Innen Verbrennungen werden erzeugt, Atemschwierigkeiten, Brustschmerzen und Lungenödeme.
Kann Ihnen dienen: Butanone: Struktur, Eigenschaften und Verwendung Schwefeltrioxid SO3 ist sehr ätzend und gefährlich. Autor: Openicons. Quelle: Pixabay.
Schwefeltrioxid SO3 ist sehr ätzend und gefährlich. Autor: Openicons. Quelle: Pixabay. Es ist giftig. Seine Einnahme erzeugt schwere Verbrennung, Speiseröhre und Magen. Darüber hinaus wird vermutet, dass es Karzinogen ist.
Feuer oder Explosion
Es repräsentiert die Brandgefahr, wenn sie mit organischen Materialien wie Holz, Fasern, Papier, Öl, Baumwolle in Kontakt kommen, insbesondere wenn sie nass sind.
Es besteht auch das Risiko, wenn Sie mit Basen oder Reduzierungen in Kontakt kommen. Es wird explosionsartig mit Wasser kombiniert und bildet Schwefelsäure.
Der Kontakt mit Metallen kann Wasserstoffgas H erzeugen H2 das ist sehr entflammbar.
Es sollte in Glasgefäßen vermieden werden, um einen möglichen heftigen Bruch des Behälters zu verhindern.
Umweltbelastung
Das so3 Es gilt als einer der größten Schadstoffe in der Erdatmosphäre. Dies ist auf seine Rolle bei der Bildung von Aerosolen und ihrem Beitrag zum sauren Regen zurückzuführen (aufgrund der Bildung von Schwefelsäure H2SW4).
 Wald durch sauren Regen in der Tschechischen Republik beschädigt. Lovecz [Public Domain]. Quelle: Wikimedia Commons.
Wald durch sauren Regen in der Tschechischen Republik beschädigt. Lovecz [Public Domain]. Quelle: Wikimedia Commons. Das so3 Es wird in der Atmosphäre aufgrund der Oxidation von Schwefeldioxid so gebildet2. Wenn das SO gebildet wird3 Dies reagiert schnell mit Wasser, um Schwefelsäure H zu bilden2SW4. Nach jüngsten Studien gibt es andere SOS -Transformationsmechanismen3 In der Atmosphäre, aber aufgrund der großen Menge an Wasser, die in diesem vorhanden ist, wird dies immer noch in Betracht gezogen3 Hauptsächlich zu H umgewandelt2SW4.
Das so3 Gas- oder industrieller gasförmiger Abfall, der es enthält, sollte nicht in die Atmosphäre heruntergeladen werden, da es sich um eine gefährliche Verunreinigung handelt. Es ist ein extrem reaktives Gas und, wie oben bereits gesagt, in Gegenwart von Feuchtigkeit der Luft die so3 Es wird Schwefelsäure H2SW4. Daher in der Luft die so3 besteht in Form von Schwefelsäure, die kleine Tröpfchen oder Aerosol bildet.
Wenn Schwefelsäure -Tröpfchen in den Atemweg des Menschen oder der Tiere eindringen, wachsen sie aufgrund der dort vorhandenen Feuchtigkeit schnell, sodass sie die Möglichkeit haben, in die Lunge zu durchdringen. Einer der Mechanismen durch den Säurenebel von H2SW4 (Das ist so3) Es kann eine starke Toxizität erzeugen, weil der extrazelluläre und intrazelluläre pH -Wert lebender Organismen (Pflanzen, Tiere und menschliches Wesen) Veränderungen verändert).
Nach Angaben einiger Forscher, also Nebel3 Es ist die Ursache für die Zunahme der Asthmatiker in einem Gebiet Japans. Der Nebel so3 Es wirkt sich sehr ätzend auf Metalle aus, sodass die vom Menschen gebauten Metallstrukturen wie einige Brücken und Konstruktionen sehr betroffen sein können.
Das so3 Flüssigkeit sollte nicht in der Entwässerung von schmutzigen Gewässern oder Abwasserkanälen verworfen werden. Wenn es in die Abwasserkanäle gegossen wird, können Sie Feuer- oder Explosionsgefahr schaffen. Wenn es versehentlich verschüttet wird, sollte ein Wasserstrom nicht auf das Produkt gerichtet werden. Es sollte niemals in Sägemehl oder anderen absorbierenden Kraftstoff aufgenommen werden, da es Feuer erzeugen kann.
Es sollte in trockenem Sand, trockenem Land oder einem anderen völlig trockenen Inert absorbiert werden. Das so3 Es sollte nicht in die Umwelt gegossen werden und sollte sich niemals damit in Verbindung setzen. Es sollte weit von Wasserquellen entfernt gehalten werden, da mit dieser Schwefelsäure erzeugt werden, die für Wasser- und Landorganismen schädlich ist.
Verweise
- Sarkar, s. et al. (2019). Einfluss von Ammoniak und Wasser auf das Schicksal des Schwefeltrioxids in der Troposphäre: theoretische Forschung an Sulfaminsäure- und Schwefelsäurebahnen. J Phys Chem a.2019; 123 (14): 3131-3141. NCBI erholte sich.NLM.NIH.Regierung.
- Muller, t.L. (2006). Schwefelsäure und Schwefeltrioxid. Kirk-Othmer-Enzyklopädie der chemischen Technologie. Band 23. Aus der Online -Bibliothek abgerufen.Wiley.com.
- ODER.S. Nationalbibliothek für Medizin. (2019). Trioxidschwefel. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung.
- Kikuchi, r. (2001). Umweltmanagement der Schwefeltrioxideinlassung: Auswirkungen von SO3 Über die menschliche Gesundheit. Umweltmanagement (2001) 27: 837. Link wiederhergestellt.Springer.com.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Ismail, m.Yo. (1979). Extraktion von Metallen aus Sulfiden unter Verwendung von Schwefeltrioxid im flüssigen Bett. J. Chem. Technik. Biotechnol. 1979, 29, 361-366. Aus der Online -Bibliothek abgerufen.Wiley.com.
- « Malawi Lago Geographie, Geologie, Wichtigkeit, Fauna, Rios
- Natriumcyanid (NACN) Struktur, Eigenschaften, Risiken, verwendet »

