Troponineigenschaften, Struktur, Funktionen und Tests
- 1563
- 144
- Medine Kedzierski
Troponin Es ist der Name, der ein Protein erhält, das im Skelett- und Herzmuskel der Wirbeltiere vorhanden ist und mit den Filamenten in den Muskelfasern verbunden ist und die Funktionen bei der Regulierung der kontraktilen Aktivität (Kontraktion und Muskelrelaxation) hat, die Funktionen haben (Kontraktion und Muskelrelaxation).
Muskelfasern sind die Zellen, aus denen das Muskelgewebe besteht, dessen Kontraktionskapazität auf der Wechselwirkung zwischen Filamenten beruht, die geordnet und innig gemacht werden, wobei der größte Teil des zytoplasmatischen Volumes einnimmt.
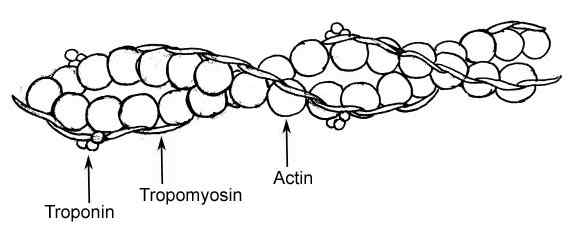 Grafische Darstellung der Elemente eines dünnen Filaments in Muskelfasern (Quelle: Raul654 über Wikimedia Commons)
Grafische Darstellung der Elemente eines dünnen Filaments in Muskelfasern (Quelle: Raul654 über Wikimedia Commons) Diese Filamente sind als Myofilamente bekannt und es gibt zwei Klassen: die Dicke und dünn. Dicke Filamente bestehen aus Myosin -II -Molekülen, während dünne Filamente globuläre Aktin- oder Aktinpolymere in Verbindung mit zwei anderen Proteinen sind.
Sowohl Actin als auch Myosin werden auch in anderen Zellen des menschlichen Körpers und anderer Organismen gefunden, nur in viel weniger proportional und an verschiedenen Prozessen wie Zellmigration, Exozytose, bei Cytocinese (während der Zellteilung) und sogar im intrazellulären Vesikularverkehr.
Troponin und Tropomiosin sind die beiden Proteine, die mit dünnen Aktinfilamenten assoziiert sind, die an der Regulation der Kontraktions- und Relaxationsprozesse von Myofibrillen von Muskelzellen oder Fasern beteiligt sind.
Die Wirkmechanismen, durch die diese beiden Proteine ihre Funktion ausüben. Das Troponin -Regulationssystem ist eines der bekanntesten Systeme in der Physiologie und Biochemie der Skelettmuskelkontraktion.
Diese Proteine sind für den Körper von großer Bedeutung. Gegenwärtig ist sicher bekannt, dass einige Familien- oder angeborene Kardiomyopathien das Produkt von Mutationen in der Sequenz der Gene sind, für die sie entweder codieren (Troponin oder Tropomiosin).
[TOC]
Eigenschaften
Troponin ist mit dem Aktin dünner Filamente von Muskelfasern in Skelett- und Herzmuskel in einem stöchiometrischen Verhältnis von 1 zu 7 verbunden.
Dieses Protein ist, wie betonte.
Es wird von einigen Autoren wie dem regulatorischen Tropomiosinprotein konzipiert. So hat es Gewerkschaftsstellen für die Wechselwirkung mit Aktinmolekülen, was ihm die Möglichkeit gibt, seine Wechselwirkung mit Myosin dicker Filamente zu regulieren.
Kann Ihnen dienen: Aldohexosa: Molekulare Struktur und BeispieleIn Myofilamenten beträgt die Beziehung zwischen Troponin und Tropomiosinmolekülen 1 zu 1, was bedeutet, dass für jeden existierenden Troponin -Komplex ein Tropomiosinmolekül mit diesem vorhanden ist.
Struktur
Troponin ist ein Proteinkomplex, der aus drei verschiedenen globulären Untereinheiten besteht.
Im menschlichen Körper gibt es für jede dieser Untereinheiten gewebespezifische Varianten, die sich auf genetischer und molekularer Ebene voneinander unterscheiden (in Bezug auf die Gene, die sie codieren), wie auf struktureller Ebene (in Bezug auf ihre Aminosäure Sequenzen).
 Darstellung einer der Untereinheiten von Troponin (Quelle: Jawahar Swaminathan und MSD -Mitarbeiter am Europäischen Bioinformatikinstitut [Public Domain] über Wikimedia Commons)
Darstellung einer der Untereinheiten von Troponin (Quelle: Jawahar Swaminathan und MSD -Mitarbeiter am Europäischen Bioinformatikinstitut [Public Domain] über Wikimedia Commons) Toponin C oder TNC ist der kleinste der drei Untereinheiten und vielleicht eines der wichtigsten. Es hat 18 kDa -Molekulargewicht und Standorte für Calcium (Ca2+).
T oder TNT Troponin ist derjenige, der die Gewerkschaftsstellen hat, um den Komplex der drei Untereinheiten nach Tropomiosin zu verankern und 30 kDa -Molekulargewicht zu haben. Es ist auch als T -Subunit- oder Tropomiosin -Übergang bekannt.
Troponin I oder TNI von etwas mehr als 180 Aminosäureabfällen hat das gleiche Molekulargewicht wie Troponin T, aber in seiner Struktur hat es die speziellen Stellen, die sich dem Aktin anschließen können, und blockiert die Wechselwirkung zwischen letzteren und Myosin, das das verantwortliche Phänomen ist Für die Kontraktion von Muskelfasern.
Viele Lehrbücher beziehen sich auf diese Untereinheit wie inhibitorische Untereinheit und als molekulare "Paste" zwischen den drei Untereinheiten von Troponin. Seine Fähigkeit zur Vereinigung zu Actin und ihre inhibitorische Aktivität wird durch den Zusammenhang mit Tropomiosin verstärkt, vermittelt durch TNT -Untereinheit.
Es wurde gezeigt, dass in der Untereinheit I die Region der für die Hemmung verantwortlichen Sequenz durch ein zentrales Peptid von 12 Aminosäureabfällen zwischen den Positionen 104 und 115 definiert wird; und dass die C-terminale Region der Untereinheit auch während der Hemmung eine Funktion hat.
Funktionen
Die Hauptfunktion von Troponin bei der Muskelkontraktion hängt von seiner Fähigkeit, Calcium beizutreten.
In Abwesenheit von Troponin können dünne Filamente unabhängig von der intrazellulären Calciumkonzentration dicke Filamente und Vertragsbefugnisse verbinden. Die Funktion von Troponin besteht darin.
Kann Ihnen dienen: ovuliparosDaher spielt Troponin eine wichtige Rolle bei der Aufrechterhaltung der Muskelrelaxation, wenn nicht genügend intrazelluläres Kalzium vorhanden ist, und bei der Muskelkontraktion, wenn der nervöse elektrische Stimulus den Calciumeintritt in Muskelfasern ermöglicht.
Wie kommt es dazu?
In Skelett- und kardialen Muskeln tritt die Muskelkontraktion dank der Wechselwirkung zwischen dünnen und dicken Filamenten auf, die übereinander gleiten.
In den Zellen dieser Muskeln ist Kalzium für die Wechselwirkung zwischen Schauspiel-Mulosin (dünne und dicke Filamente) von wesentlicher Bedeutung, da die Gewerkschaftsstellen des Actin für Myosin durch die gemeinsame Wirkung von Tropomiosin und Troponin „versteckt“ sind, was reagiert zu Kalzium.
Die Kalziumionen, die aus dem sarkoplasmatischen Retikulum (dem endoplasmatischen Retikulum der Muskelfasern) stammen.
Die "Neutralisation" der durch Untereinheit I verursachten Hemmung tritt nach der Vereinigung von Kalzium in die Untereinheit C auf, was eine Konformationsänderung erzeugt.
Diese Dissoziation zwischen Troponin, Tropomiosin und Actin enthüllt in den Aktin der Union für Myosin. Dann können die kugelförmigen Köpfe des letzteren mit den Aktinfasern interagieren und die ATP-abhängige Kontraktion aufgrund der Verschiebung eines Filaments über das andere initiieren.
Troponin -Test
Troponin ist der bevorzugte Biomarker zum Nachweis von Herzläsionen. Daher wird der Troponin -Test in der biochemischen, frühen und/oder vorbeugenden Diagnose einiger kardialer pathologischer Erkrankungen wie akutem Myokardinfarkt häufig verwendet.
Viele behandelnde Ärzte sind der Ansicht, dass dieser Test die Entscheidung erleichtert, was zu tun ist und welche Behandlung bei Patienten mit Brustschmerzen verabreicht wird.
Im Allgemeinen hängt es mit dem Nachweis von T- und I -Untereinheiten des Troponins zusammen, da die Troponin -C -Isforma auch in den Skelettmuskeln der langsamen Kontraktion vorkommt; Das heißt, es ist nicht spezifisch für das Herz.
Was ist der Troponin -Test basiert??
Der Troponin -Test ist normalerweise eine Immunstudie, die Herzisoformen von T- und I -Untereinheiten von Troponin erkennt. Dann basiert es auf den Unterschieden, die zwischen beiden Isoformen bestehen.
Kann Ihnen dienen: ProteinsyntheseIsoform der Toponin I (CTNI) Untereinheit (CTNI)
Im Muskelgewebe des Myokards gibt es nur eine Isoform der Untereinheit I des Troponins, die durch das Vorhandensein eines posttranslationalen "Schwanzes" von 32 Aminosäuren am N-terminalen Ende gekennzeichnet ist.
Diese Isoform wird dank der Entwicklung spezifischer monoklonaler Antikörper nachgewiesen, die andere nicht kardiale Isoformen nicht erkennen.
Der CTNI wird nicht in beschädigten Stoffen ausgedrückt, sondern ist ausschließlich für erwachsene Herzgewebe.
Isoform der Troponin T (CTNT) Untereinheit (CTNT)
Die Herzisoform der Untereinheit des Troponins ist in drei verschiedenen Genen codiert, deren ARNM alternative Schnitte und Spleiß.
Obwohl der Herzmuskel des Menschen 4 TNT -Isoformen enthält, ist nur einer ein Merkmal des Herzgewebes eines Erwachsenen. Dies wird mit spezifischen Antikörpern nachgewiesen, die gegen das N-terminale Ende seiner Aminooacidal-Sequenz entwickelt wurden.
Die Tests für die „neue Generation“ für die Untereinfindigkeit t der Herzisoformen achten sehr darauf.
Verweise
- Babuin, l., & Jaffe, a. S. (2005). Troponin: Der Biomarker der Wahl zum Nachweis von Herzverletzungen. CMAJ, 173(10), 1191-1202.
- Collinson, p., Stubbs, p., & Kessler, a.-C. (2003). Multizentrische Bewertung des diagnostischen Wertes von Herz Troponin T, CK-MB-Masse und Myoglobin zur Bewertung von Patienten mit Verdacht auf akute koronare Syndrome in der routinemäßigen klinischen Praxis. Herz, 89, 280-286.
- Farah, c., & Reinach, f. (1995). Der Troponinkomplex und die Regulierung der Muskelkontraktion. Faseb, 9, 755-767.
- Keller, t., Peetz, d., Tzikas, s., Roth, a., Czyz, e., Bickel, c.,... Blankenberg, s. (2009). Sensitive Troponin I Assay bei der frühen Diagnose einer akuten Myokardinfarbe. Das New England Journal of Medicine, 361(9), 868-877.
- Ross, m., & Pawina, w. (2006). Histologie. Ein Text und Atlas mit korrelierter Zell- und Molekularbiologie (5. Aufl.). Lippinott Williams & Wilkins.
- Wakabayashi, t. (2015). Mechanismus der Kalziumregulation der Muskelkontraktion. In der Verfolgung seiner strukturellen Grundlage. Proc. JPN. Acade. Sei. B, 91, 321-350.
- « Tropomiosineigenschaften, Struktur und Funktionen
- Empfindliches Wärmekonzept, Formeln und Übungen gelöst »

