Wolframgeschichte, Eigenschaften, Struktur, verwendet

- 3654
- 172
- Ibrahim Steuk
Er Wolfram, Wolframio oder Volframium ist ein schweres Übergangsmetall, dessen chemisches Symbol W ist. Es befindet sich in Periode 6 mit Gruppe 6 des Periodensystems, und seine Atomzahl beträgt 74. Sein Name hat zwei etymologische Bedeutungen: Hartstein und Wolfsschaum; Der zweite ist, weil dieses Metall auch als Wolframio bekannt ist.
Es ist ein silbergraues Metall und hat, selbst wenn es zerbrechlich ist, große Härte, Dichte sowie hohe Fusions- und Siedepunkte. Daher wurde es in all jenen Anwendungen verwendet, die hohe Temperaturen, Drücke oder mechanische Kräfte wie Bohrer, Projektile oder Strahlungsfilamente beinhalten.
 Wolfram mit seiner teilweise oxidierten Oberfläche. Quelle: Hi-Res-Bilder von chemischen Elementen [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)]]
Wolfram mit seiner teilweise oxidierten Oberfläche. Quelle: Hi-Res-Bilder von chemischen Elementen [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)]] Die bekannteste Verwendung für dieses Metall in Kultur und Volksniveau liegt in den Filamenten der elektrischen Glühbirnen. Wer sie manipuliert hat, wird erkennen, wie zerbrechlich sie sind; Sie bestehen jedoch nicht aus reinem Wolfram, was formbar und duktil ist. Darüber hinaus bietet es in Metallmatrizen wie Legierungen hervorragende Widerstand und Härte.
Es ist charakterisiert und unterschieden, indem es das Metall mit dem höchsten Fusionspunkt ist und auch dichter als der gleiche Blei, nur durch andere Metalle wie Osmium und Iridium übertroffen wird. Es ist auch das schwerste Metall, von dem bekannt ist, dass es eine biologische Rolle im Körper spielt.
In den meisten seiner ionischen Verbindungen beteiligt sich das Wolframanion, wo42-, Dies kann polymerisieren, um Cluster in einem sauren Medium zu verursachen. Andererseits kann das Wolfram intermetallische Verbindungen bilden oder mit Metallen oder anorganischen Salzen sterisieren, damit ihre Feststoffe verschiedene Formen oder Konsistenzen erwerben.
Es ist im Erdkortex nicht sehr reichlich vorhanden, als eine Tonne nur 1,5 Gramm dieses Metalls. Da es sich um ein schweres Element handelt, ist sein Ursprung intergalaktisch; Speziell der Explosionen der Supernovas, die während ihrer Formation „Jets“ von Wolframatomen auf unseren Planeten werfen mussten.
[TOC]
Geschichte
Etymologie
Die Geschichte des Wolframio hat zwei Gesichter sowie ihre Namen: eine Schweizer und der andere Deutsche. In den 1600er Jahren arbeiteten die Bergleute in Regionen, die derzeit von Deutschland und Österreich besetzt sind.
Bis dahin trafen die Bergleute dabei einen Dorn: Es gab ein äußerst schwieriges Mineral; Mineral bestand aus Wolframit, (Glaube, MN, Mg) WO4, die blieb oder "verschlungen" Zinn, als wäre es ein Wolf.
Daher die Etymologie für dieses Element, "Wolf" des Wolfes auf Spanisch, ein Wolf, der Zinn aß; und "Widder" von Schaum oder Creme, deren Kristalle einem langen schwarzen Fell ähnelten. Es war so, dass der Name 'Wolfram' oder 'Wolframio' zu Ehren dieser ersten Beobachtungen entstand.
1758 auf der Schweizer Seite zu einem ähnlichen Mineral, der Scheelita, Cawoo4, Er wurde "Tung Sten" genannt, was "harter Stein" bedeutet.
Beide Namen Wolframio und Wolfram werden je nach Kultur austauschbar verwendet. Zum Beispiel in Spanien und im europäischen Westen ist dieses Metall eher von Wolframio bekannt. Während des amerikanischen Kontinents überwiegt der Name des Wolframs.
Anerkennung und Entdeckung
Es war dann bekannt, dass es zwischen dem 17. und 18. Jahrhundert zwei Mineralien gab: die Wolframit und die Scheelita. Aber wer schob sich, dass es ein anderes Metall als die anderen gab? Sie konnten nur als Mineralien charakterisiert werden, und 1779 analysierte der irische Chemiker Peter Woulfe das Wolframit sorgfältig und leitete die Existenz von Wolframium ab.
Es kann Ihnen dienen: Perbromensäure (Hbro4): Eigenschaften, Risiken und VerwendungAuf der Schweizer Seite konnte Carl Wilhelm Scheele 1781 das Wolfram als wo isolieren3; Und noch mehr erhielt er tumatische (oder wolphramische) Säure H2Wo4 und andere Verbindungen.
Dies reichte jedoch nicht aus, um reines Metall zu erreichen, da es notwendig war, diese Säure zu reduzieren. Das heißt, sie unterlegen einem solchen Prozess, der Sauerstoff nicht nicht als Metall kristallisiert wird. Carl Wilhelm Scheele hatte nicht die geeignete Methodik für diese Reaktion der chemischen Reduktion.
Hier reduzierten die spanischen Brüder D'Aluyar, Fausto und Juan José, die beide Mineralien (Wolframit und Scheelita) mit Kohle in der Stadt Bergara in der Stadt Bergara reduzierten. Zwei erhalten das Verdienst und die Ehre, die Entdecker des Wolframiums oder des metallischen Wolframs (W) zu sein.
Stähle und Glühbirnen
 Jede Glühbirne mit Wolframfilament. Quelle: pxhere.
Jede Glühbirne mit Wolframfilament. Quelle: pxhere. Wie andere Metalle definieren seine Verwendung seine Geschichte. Zu den am stärksten am Ende des 19. Jahrhundert. Man kann sagen, dass die ersten Glühbirnen, wie wir sie kennen, 1903-1904 vermarktet wurden.
Eigenschaften
Aussehen
Es ist ein silberndes und glänzendes graues Metall. Zerbrechlich, aber großer Härte (nicht verwirrend mit Hartnäckigkeit). Wenn das Stück von hoher Reinheit ist, wird es formbar und hart, sowohl oder mehr als auch mehrere Stähle.
Ordnungszahl
74.
Molmasse
183,85 g/mol.
Schmelzpunkt
3422ºC.
Siedepunkt
5930ºC.
Dichte
19,3 g/ml.
Fusionshitze
52,31 kJ/mol.
Verdampfungswärme
774 kJ/mol.
Molarenwärmekapazität
24,27 kJ/mol.
Moh Härte
7.5.
Elektronegativität
2,36 auf der Paulingskala.
Atomradio
139 Uhr
Elektrischer widerstand
52.8 Nω · m bei 20ºC.
Isotope
Es präsentiert sich überwiegend in der Natur als fünf Isotope: 182W, 183W, 184W, 186W und 180W. Gemäß der Molmasse von 183 g/mol, die die Atommassen dieser Isotope (und die anderen dreißig Radioisotope) im Durchschnitt ermöglicht, hat jedes Atom von Wolfram oder Wolframium etwa einhundertdzehn Neutronen (74 + 110 = 184).
Chemie
Es ist sehr beständig gegen Korrosionsmetall, wie seine dünne WO -Schicht3 schützt es vor dem Angriff von Sauerstoff, Säure und Alkalis. Sobald sie gelöst und mit anderen Reagenzien ausgefällt wurden, werden ihre Salze erhalten, die als Wolframate oder Wolframate bezeichnet werden. In ihnen hat das Wolfram einen Oxidationszustand von +6 (vorausgesetzt, es gibt Kationen W6+).
Säureclustering
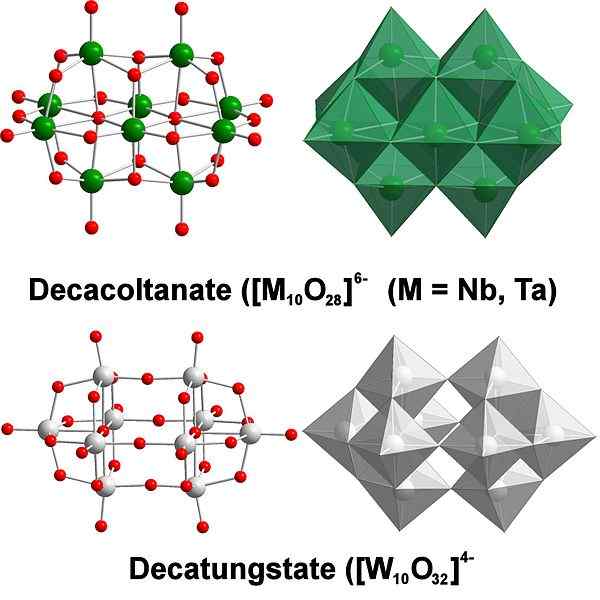 Decatungstate, ein Beispiel für wolfram -polyaxomethalate. Quelle: Scifanz [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Decatungstate, ein Beispiel für wolfram -polyaxomethalate. Quelle: Scifanz [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Chemisch ist das Wolfram ganz Besonderes, weil seine Ionen dazu neigen, zu heteropolycids oder polyaxomethalat zu gruppieren (in Englisch) zu bilden. Was sind Sie? Sie sind Gruppen oder Cluster von Atomen, die an einen dreidimensionalen Körper definieren; Hauptsächlich eine mit kugelförmiger Käfigstruktur, in der sie ein anderes Atom "einschließen".
Alles beginnt vom Wolfram -Anion, wo42-, Die in saurem Medium protoniert (hWO4-) und verbunden mit einem benachbarten Anion, um sich zu formen [W2ENTWEDER7(OH)2]2-; Und dies wiederum schließt sich einem anderen an [w2ENTWEDER7(OH)2]2- Die [W4ENTWEDER12(OH)4]4-. Bis in Lösung gibt es mehrere Polytungstates.
Kann Ihnen dienen: Lithiumchlorid (LICL): Eigenschaften, Risiken und VerwendungParathungstate A und B, [W7ENTWEDER24]6- und h2W12ENTWEDER4210-, Sie sind jeweils einer der herausragendsten dieser Polyaden.
Es kann eine Herausforderung werden, seine Skizzen- und Lewis -Strukturen zu berücksichtigen. Aber es reicht grundsätzlich aus, sie als WO Octaedra -Sets zu visualisieren6 (oberes Bild).
Beachten Sie, dass diese grauen Oktaeder am Ende Decatungstate, einen Politung, definiert; Wenn ein Heteroátomo im Inneren (zum Beispiel Phosphor) lockert, wäre es ein Polyaxomethalat.
Elektronische Struktur und Konfiguration
Kristalline Phasen
Wolframatome definieren eine kubische Struktur, die mit dem Körper zentriert ist (BCC, von Käferzeigerter Kubikum). Diese kristalline Form ist als α -Phase bekannt; Während die β -Phase auch kubisch, aber etwas dicht ist. Beide Phasen oder kristalline Formen, α und β, können unter normalen Bedingungen im Gleichgewicht koexistieren.
Die kristallinen Körner der α -Phase sind isometrisch, während die der β -Phase Säulen ähneln. Unabhängig davon, wie das Glas ist, in dieser Regierung. Ansonsten konnten die hohen Schmelz- und Siedepunkte nicht erklärt werden oder die hohe Härte und Dichte des Wolframs.
Metallverbindung
Wolframatome müssen irgendwie sehr vereint sein. Um eine Vermutung zu erhöhen, sollte zuvor die elektronische Konfiguration dieses Metalls beobachtet werden:
[Xe] 4f145 d46s2
5D -Orbitale sind sehr groß und verschwommen, was implizieren würde, dass zwischen zwei engen Atomen mit wirksamen Orbitalüberlappungen bestehen. Auch Orbitale 6s tragen zu den resultierenden Bändern bei, jedoch in geringerem Maße. Während die 4F -Orbitale "sehr tief im Inneren" haben und deren Beitrag zur metallischen Verbindung niedriger ist.
Dies, die Größe der Atome und die kristallinen Körner, sind die Variablen, die die Härte des Wolframs und seiner Dichte bestimmen.
Oxidationszustände
Im Wolfram- oder metallischen Wolframium haben die Atome W keinen Oxidationszustand (W0). Rückkehr zur elektronischen Konfiguration können 5D und 6S -Orbitale Elektronen "leeren", je nachdem, ob W in Begleitung sehr elektronegativer Atome wie Sauerstoff oder Fluor ist.
Wenn die beiden 6S -Elektronen verloren gehen, hat der Wolfram den Oxidationszustand +2 (w2+), Was erzeugt diesen Atomvertrag.
Wenn Sie auch alle Elektronen Ihrer 5D -Orbitale verlieren, wird Ihr Oxidationsstatus +6 (w6+); Von hier aus kann es nicht positiver werden (theoretisch), da die 4F -Orbitale für interne große Energien erfordern würden. Das heißt, der positivste Oxidationszustand ist +6, wo der Wolfram noch klein ist.
Dieser Wolfram (VI) ist unter sauren Bedingungen oder in vielen sauerstoffhaltigen oder halogenierten Verbindungen sehr stabil. Andere positive und mögliche Oxidationszustände sind: +1, +2, +3, +4, +5 und +6.
Wolfram kann auch Elektronen gewinnen, wenn sie mit weniger elektronegativen Atomen kombiniert als er. In diesem Fall werden ihre Atome größer. Es kann maximal vier Elektronen gewinnen; das heißt, einen Oxidationszustand von -4 (W4-).
Erhalten
Zuvor wurde erwähnt, dass der Wolfram in Wolframit- und Scheelita -Mineralien vorkommt. Abhängig vom Prozess werden zwei Verbindungen von ihnen erhalten: Wolframoxid, wo3, oder Ammonium Paratungstate (NH4)10(H2W12ENTWEDER42) · 4h2O (oder ATP). Jeder von ihnen zwei kann mit Kohle über 1050 ° C auf metallische W reduziert werden.
Es kann Ihnen dienen: Raault Law: Prinzip und Formel, Beispiele, ÜbungenEs ist wirtschaftlich nicht profitabel. Deshalb wird es bevorzugt, es in Form von Staub zu produzieren, um einmal mit anderen Metallen umzugehen, um Legierungen zu erhalten.
Es ist erwähnenswert, dass Chinas Welt das Land mit der größten Produktion von Wolfram ist. Auf dem amerikanischen Kontinent, Kanada, Bolivien und Brasilien belegen sie auch die Liste der größten Produzenten dieses Metalls.
Anwendungen
 Eine Wolfram -Carbid -Verbindung: Ein Beispiel dafür, wie die Härte dieses Metalls verwendet werden kann, um Materialien zu verewigen und zu verhärten. Quelle: SolitaryAngel (SolitaryAngel) [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Eine Wolfram -Carbid -Verbindung: Ein Beispiel dafür, wie die Härte dieses Metalls verwendet werden kann, um Materialien zu verewigen und zu verhärten. Quelle: SolitaryAngel (SolitaryAngel) [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Einige der bekannten Verwendungen für dieses Metall werden unten erwähnt:
-Seine Salze wurden zum Färben von Häusern aus alten Theatern verwendet.
-In Kombination mit Stahl härtet es noch mehr, selbst wenn es in der Lage ist, mechanische Schnitte bei hohen Geschwindigkeiten zu widerstehen.
-Wolfram -Sinterfilamente werden seit mehr als hundert Jahren in elektrischen Zwiebeln und halogenierten Lampen verwendet. Aufgrund seines hohen Schmelzpunkt.
-Ersetzt Blei bei der Herstellung von Projektilen und radioaktiven Schildern.
-Wolfram -Nanokabeln können in pH -sensitiven Nanodispositiven verwendet werden.
-Wolframkatalysatoren wurden verwendet, um mit der Schwefelproduktion in der Ölindustrie umzugehen.
-Wolframcarbid stammt aus all seinen Verbindungen, die mehr Verwendungszwecke abdecken. Aus der Stärkung von Schnitten und Bohrwerkzeugen oder der Herstellung von Militärwaffenstücken, um Holz, Kunststoff und Keramik zu mechanisieren.
Risiken und Vorsichtsmaßnahmen
Biologisch
Als relativ seltenes Metall in der Erdkruste sind seine negativen Auswirkungen knapp. In sauren Böden beeinflussen Polytungstate möglicherweise nicht die von Molybdaten verwendeten Enzyme; Aber in grundlegenden Böden die wo42- Es greift (positiv oder negativ) in die Stoffwechselprozesse des MOO ein42- und Kupfer.
Die Pflanzen können zum Beispiel die löslichen Verbindungen von Wolfram und durch das Essen eines Tieres und nach dem Verzehr ihres Fleisches in unsere Organismen eingehen. Die meisten sind in Urin und Kot ausgewiesen, und es ist wenig bekannt, was mit den anderen passiert.
Tierstudien zeigten, dass bei hohen Konzentrationen von Wolframpulver Symptome ähnlich wie Lungenkrebs.
Durch Einnahme müsste ein erwachsener Mensch Tausende von Gallonen Wasser trinken, die mit Wolfragssalzen angereichert sind, um eine nennenswerte Hemmung von Colinesterase- und Phosphatase -Enzymen zu zeigen.
Physisch
Im Allgemeinen ist Tungsten ein wenig giftig.
In Bezug auf metallische Wolfram sollten Sie vermeiden, seinen Staub zu atmen. Und wenn die Probe fest ist, muss berücksichtigt werden, dass sie sehr dicht ist und dass sie physische Schäden verursachen kann, wenn sie fällt oder andere Oberflächen trifft.
Verweise
- Bell Terence. (S.F.). Wolfram (Wolfram): Eigenschaften, Produktion, Anwendungen und Legierungen. Die Balance. Erholt von: THEABALANCE.com
- Wikipedia. (2019). Wolfram. Abgerufen von: in.Wikipedia.Org
- Lentech b.V. (2019). Wolfram. Erholt von: lentech.com
- Jeff Desjardins. (1. Mai 2017). Die Geschichte von Wolfram, das stärkste natürliche Metall der Erde. Erholt von: visualcapitalistisch.com
- Doug Stewart. (2019). Tungsten -Element -Fakten. Erholt von: Chemicoolool.com
- Art Fisher und Pam Powell. (S.F.). Wolfram. Universität von Nevada. Erholt von: unce.a r.Edu
- Helmestine, Anne Marie, ph.D. (2. März 2019). Wolfram- oder Wolfram -Fakten. Erholt von: thoughtco.com

