Valina -Eigenschaften, Funktionen, reiche Lebensmittel, Vorteile
- 3380
- 320
- Ivan Pressler
Der Valina Es gehört zu den 22 Aminosäuren, die als "grundlegende" Komponenten von Proteinen identifiziert wurden. Es wird mit dem Akronym "Val" und dem Buchstaben "V" identifiziert. Diese Aminosäure kann nicht vom menschlichen Körper synthetisiert werden, daher wird sie in der Gruppe von neun essentiellen Aminosäuren für den Menschen katalogisiert.
Viele kugelförmige Proteine haben ein innenreiches Innenraum an Valin- und Leucinabfällen, da beide durch hydrophobe Wechselwirkungen assoziiert sind und für die Faltung der Struktur und die dreidimensionale Konformation von Proteinen unverzichtbar sind.
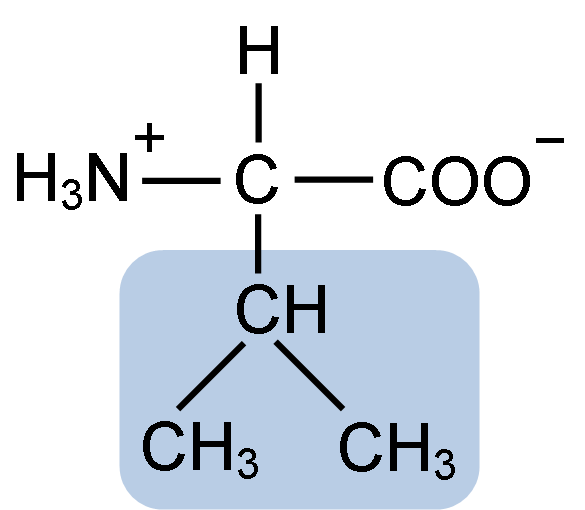
 Chemische Struktur von Aminosäure-Valin (Quelle: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Chemische Struktur von Aminosäure-Valin (Quelle: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) La Valina wurde 1856 von V zum ersten Mal gereinigt. Grup-Besanez aus einem wässrigen Extrakt der Bauchspeicheldrüse. Der Name "Valina" wurde jedoch von E geprägt. Fisher im Jahr 1906, als er es künstlich synthetisierte und beobachtete, dass seine Struktur der der tapferhaften Säure sehr ähnlich war, die in Pflanzen vorkommt, die allgemein als "Balerianas" bekannt sind.
Das Valin ist eine der Aminosäuren, die in Positionen enthalten sind, die in bestimmten Proteinen aufbewahrt werden, die von Wirbeltieren in der 80 -Position von Cytochrom C von Wirbeltieren in der gleichen Reihenfolge in der gleichen Reihenfolge in der gleichen Reihenfolge in der 80er -Position von Wirbeltieren aufbewahrt werden, in derselben Reihenfolge sind.
In Geweben oder Biomaterialien mit resistenten, harten und elastischen Eigenschaften wie Bändern, Sehnen, Blutgefäßen, Fäden oder Netz.
Ein Ersatz eines Glutamatrests durch einen Valin in der β -Hämoglobinkette, das für den Transport von Sauerstoff durch Blut verantwortliche Protein führt zu einer schlechten Bildung in der Proteinstruktur, die Hämoglobin "S" verursacht.
Diese Mutation erzeugt Falciform Anämie oder Drepanozytose, eine pathologische Erkrankung, bei der rote Blutkörperchen eine Form von Halbmond oder charakteristischem Hoz erwerben, das sie von normalem, abgerundetem und abgeflachtem Erscheinungsbild unterscheidet.
Einige der am häufigsten verwendeten Herbizide verfügen derzeit über aktive Verbindungen zu Sulfonylharnstoff und Methylsulfometuron, die die für den erste Schritt der Synthese des Valin, Leucin und Isoleucin notwendige Beschädigung des Enzymacetolactat -Synthase verursachen. Der durch diese Pestizide verursachte Schaden verhindert, dass Kräuter und Unkraut normalerweise entwickeln können.
[TOC]
Eigenschaften
Valina ist eine Aminosäure mit einem Fünf -Zarbon -Skelett und gehört zur Aminosäuregruppe mit aliphatischen Seitenketten. Sein hydrophober Charakter ist so, dass er mit dem von Phenylalanin verglichen werden kann, der von Leucin und dem von Isoleucin.
Aminosäuren mit Kohlenwasserstoffketten in ihren R -oder Seitenketten sind in der Bibliographie allgemein als verzweigte oder verzweigte Aminosäuren bekannt. In dieser Gruppe sind Valin, Phenylalanin, Leucin und Isoleucin.
Im Allgemeinen werden die Aminosäuren dieser Gruppe als interne strukturelle Elemente in der Proteinsynthese verwendet, da diese durch hydrophobe Wechselwirkungen miteinander verbunden werden können, die aus Wasser "fliehen" und die charakteristische strukturelle Faltung vieler Proteine herstellen können.
Sein Molekulargewicht liegt bei 117 g/mol und da es sich um eine verzweigte Kohlenwasserstoffgruppe handelt, hat es keine Last und seine relative Häufigkeit in Proteinstrukturen ist etwas größer als 6%.
Struktur
La Valina teilt die allgemeine Struktur und die drei typischen chemischen Gruppen aller Aminosäuren: die Carboxylgruppe (COOH), die Amino-Gruppe (NH2) und ein Wasserstoffatom (-h). In seiner R- oder Seitenkettengruppe hat sie drei Kohlenstoffatome, die ihm sehr hydrophobe Eigenschaften verleihen.
Kann Ihnen dienen: Inertwesen: Merkmale, Beispiele, Unterschiede zu LebewesenWie für alle chemischen Verbindungen, die als "Aminosäuren" klassifiziert sind.
Der IUPAC-Name des Valine ist 2-3-Amino-3-Butanóic.
Alle Aminosäuren sind in der D oder L -Form zu finden, und der Valin ist keine Ausnahme. Die L-Wert-Form ist jedoch viel häufiger als die D-Vallein-Form und außerdem spektroskopisch aktiver als die Form D.
L-Wert ist die Form, die zur Bildung von Zellproteinen verwendet wird und daher die biologisch aktive Form ist. Es erfüllt Funktionen wie Nutraceutical, Mikronährstoff für Pflanzen, Metaboliten für Menschen, Algen, Hefen und Bakterien, unter anderem.
Funktionen
Valina spielt trotz einer der neun essentiellen Aminosäuren keine zusätzliche Rolle bei der Teilnahme an der Proteinsynthese und als Metaboliten auf seiner eigenen Verschlechterung.
Sperrige Aminosäuren wie Valin und Tyrosin sind jedoch für die Flexibilität von Fibroin verantwortlich, die Hauptproteinkomponente von Seidenfäden, die von den Spezies erzeugt werden Bombyx Mori, allgemein bekannt als Seiden- oder Maulbeerbaumwürmer.
Gewebe wie arterielle Blut ligamente und Gläser bestehen aus einem faserigen Protein, das als Elastin bekannt ist. Dies besteht aus Polypeptidketten mit wiederholten Sequenzen von Glycin-, Alanin- und Valin -Aminosäuren, dem wichtigsten Rest mit Protein.
Valina nimmt an den Hauptsynthesestraßen der Verbindungen teil, die für den charakteristischen Geruch von Früchten verantwortlich sind. Valina -Moleküle werden in methylierte und verzweigte Derivate von Estern und Alkoholen umgewandelt.
In der Lebensmittelindustrie
Es gibt viele chemische Additive, die Valin in Kombination mit Glukose verwenden, um in bestimmten kulinarischen Präparaten appetitliche Gerüche zu erhalten.
Bei einer Temperatur von 100 ° C haben diese Zusatzstoffe einen charakteristischen Roggengeruch und mehr als 170 ° C in heißer Schokolade, sodass sie in der Lebensmittelproduktion in der Bäcker- und Konditorei (Konditorei) beliebt sind (Gebäck).
Diese chemischen Additive verwenden künstlich synthetisiertes L-Valin.
Biosynthese
Alle verzweigten Kettenaminosäuren wie Valin, Leucin und Isoleucin werden hauptsächlich in Pflanzen und Bakterien synthetisiert. Dies bedeutet, dass Tiere wie menschliches Wesen und andere Säugetiere Lebensmittel einnehmen müssen, die reich an diesen Aminosäuren sind, um ihre Ernährungsbedürfnisse erfüllen zu können.
Normalerweise beginnt die Biosynthese des Valins mit der Übertragung von zwei Kohlenstoffatomen aus dem Hydroxyethyl -Tyamin -Pyrophosphat auf das Pyruvat durch die Wirkung des Enzyms Ocetohydroxi -Isomer -Säure -Reduktase -Säure.
Die beiden Kohlenstoffatome stammen aus einem zweiten Pyruvatmolekül durch eine TPP-abhängige Reaktion, die dem durch das Enzym-Discarboxylase-Pyruvat katalysierte Reaktion sehr ähnlich ist, das jedoch durch Dihydroxy-Säure-Dehydratase katalysiert wird.
Das Enzym Valina Aminotransferase enthält schließlich eine Amino-Gruppe zur Ketoacid-Verbindung, die aus der vorderen Dekarboxylierung resultiert, die das L-Valin bildet. Leucin-, Isoleucin- und Valin -Aminosäuren haben eine große strukturelle Ähnlichkeit, und dies liegt daran, dass viele Vermittler und Enzyme auf ihren Biosynthesewegen teilen.
Es kann Ihnen dienen: Flora und Fauna de Salta: repräsentativere ArtenDas während der Biosynthese des L-Valin produzierte Ketoacid reguliert einige enzymatische Schritte durch negative Rückkopplung oder alosterische Regulation auf dem Biosyntheseweg von Leucin und anderen verwandten Aminosäuren.
Dies bedeutet, dass Biosynthesewege durch einen darin erzeugten Metaboliten gehemmt werden, der beim Akkumulieren Zellen ein spezifisches Signal gibt, das ihnen sagt, dass eine bestimmte Aminosäure übermäßig ist und daher ihre Synthese aufhören kann.
Degradierung
Die ersten drei Abbauschritte des Valins werden auf den Abbauweg aller verzweigten Aminosäuren geteilt.
Valina kann in den Krebs-Zitronensäurezyklus eintreten, um in Succinyl-CoA umzuwandeln. Die Verschlechterungsroute besteht aus einer anfänglichen Transaminierung, die durch ein Enzym, das als Aminotransferase von verzweigten Kettenaminosäuren (BCAT) bekannt ist, katalysiert wird.
Dieses Enzym katalysiert eine reversible Transaminierung, die es schafft, die verzweigten Kette-Aminosäuren in ihre entsprechenden verzweigten α-Zo-Scherz umzuwandeln.
In dieser Reaktion ist die Teilnahme des Glutamat/2-Zotoglutarat-Drehmoment.
Dieser erste Reaktionsschritt des Katabolismus des Valins erzeugt den 2-Cethoisavaleraten und wird von der Umwandlung von Pyridoxal 5'-Phosphat (PLP) in Pyridoxamin 5'-Phosphat (PMP) begleitet.
Dann wird das 2-Cethoisvalerat als Substrat eines mitochondrialen enzymatischen Komplexes verwendet, der als α-α-Zo-Scherz der verzweigten Kette bekannt ist, der einen Coash-Anteil hinzufügt und den Isobutiril-CoA bildet -Coa.
Methacrylil-CoA wird in 5 zusätzlichen enzymatischen Schritten stromabwärts verarbeitet.
Lebensmittel, die reich an Valina sind
Die im Sesam oder Sesam enthaltenen Proteine sind reich an Valina, mit fast 60 mg Aminosäure für jedes Gramm Protein. Aus diesem Grund werden Kekse, Kekse und Sesambalken oder Nougat für Kinder mit mangelhaften Diäten dieser Aminosäure empfohlen.
Soja -Körner sind im Allgemeinen reich an allen wesentlichen Aminosäuren, auch in Valina. Sie sind jedoch schlecht in Metionin und Cystein. Das Protein oder die Soja -Struktur verfügt.
Casein, das typischerweise in Milch und seinen Derivaten ist, ist reich an wiederholten Sequenzen von Valina. Wie Sojabohnen wird dieses Protein leicht abgebaut und in den Darmtrakt von Säugetieren absorbiert.
Es wurde geschätzt, dass für 100 Gramm Soja -Protein etwa 4,9 Gramm Valin aufgenommen werden; Während jeder 100 ml Milch werden etwa 4,6 ml Valina aufgenommen.
Andere Lebensmittel, die reich an Aminosäure sind, sind Rindfleisch, Fisch und verschiedene Arten von Gemüse und Gemüse.
Vorteile Ihrer Aufnahme
Valin ist wie ein großer Teil von Aminosäuren eine glykogene Aminosäure, dh sie kann in den gluconeogenen Weg einbezogen werden, und viele Neurologen bestätigen, dass ihre Aufnahme dazu beiträgt.
Kann Ihnen dienen: die 5 Zweige der HauptbiotechnologieViele Athleten konsumieren komprimiert in Valina, da sie die Regeneration von Geweben, insbesondere Muskelgewebe, helfen. Eine Aminosäure, die in der Lage ist, Gluconeogenese zusammenzuführen.
Valina -Lebensmittel tragen dazu bei, das Gleichgewicht von Stickstoffverbindungen im Körper aufrechtzuerhalten. Dieses Gleichgewicht ist für die Erzeugung von Energie aus den aufgenommenen Proteinen für Körperwachstum und Heilung von wesentlicher Bedeutung.
Der Verbrauch verhindert Schäden an Leber und Gallenblase sowie zur Optimierung vieler Körperfunktionen.
Einer der beliebtesten Nahrungsergänzungsmittel zwischen Sportlern, um das Muskelvolumen und die Muskelwiederherstellung zu erhöhen, ist BCAA.
Diese Tablettenarten bestehen aus Tabletten mit Gemischen unterschiedlicher Aminosäuren, unter denen im Allgemeinen Aminosäuren wie L-Valin, L-Isoleucin und L-Leucina enthalten sind. Sie sind auch reich an Vitamin B12 und anderen Vitaminen.
Einige Experimente mit Schweinen haben gezeigt, dass die Anforderungen an die Valine für Mütter während des Stillstadiums viel höher sind und einschränkender sind, da diese Aminosäure dazu beiträgt.
Mangelerkrankungen
Die tägliche Valinenaufnahme, die für Säuglinge empfohlen wird, beträgt etwa 35 mg für jedes Gramm Eiweißverbrauch, während für Erwachsene die Menge etwas niedriger ist (ca. 13 mg).
Die häufigste Krankheit im Zusammenhang mit dem Valin und anderen verzweigten Aminosäuren ist als "Urinkrankheit mit ARCE -Sirup" oder "Ketoacidurie" bezeichnet.
Dies ist eine erbliche Erkrankung, die durch einen Defekt in den Genen verursacht wird, die für die Dehydrogenenzyme der α-Zo-Säure aus Leucin, Isoleucin und Valin kodieren, die erforderlich sind, um sie zu metabolisieren.
Bei dieser Krankheit kann der Organismus keine dieser drei Aminosäuren assimilieren, wenn sie aus der Ernährung erhalten werden.
Andererseits wurde eine schlechte Ernährung in Valina mit neurologischen Pathologien wie Epilepsie zusammenhängen. Es kann auch zu Gewichtsverlust und Huntington -Krankheit führen und sogar in der Entwicklung bestimmter Krebsarten enden, da das Gewebereparatursystem und die Synthese von Biomolekülen beeinträchtigt sind.
Verweise
- Abu-Baker, s. (2015). Überprüfung der Biochemie: Konzepte und Verbindungen
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehninger Prinzipien der Biochemie. Macmillan.
- Plimmer, r. H. ZU., & Phillips, h. (1924). Die Analyse von Proteinen. III. Abschätzung von Histidin und Tyrosin durch Bomination. Biochemisches Journal, 18 (2), 312
- Plimmer, r. H. ZU. (1912). Die chemische Konstitution der Proteine (vol. 1). Longmans, grün.
- Torii, k. ZU. Z. ODER. ENTWEDER., & Iitaka und. (1970). Die Kristallstruktur von L-Valin. Kristallographica Abschnitt B: Strukturkristallographie und Kristallchemie, 26 (9), 1317-1326.
- Tosti, v., Bertozzi, geb., & Fontana, l. (2017). Gesundheitliche Vorteile der mediterranen Ernährung: Stoffwechsel- und Molekularmechanismen. Die Zeitschriften der Gerontologie: Serie A, 73 (3), 318-326.
- « Formeln für Gravitationsenergie, Eigenschaften, Anwendungen, Übungen
- Die 115 besten Sätze über Eleganz »

